-
평점

-
작성일 2020-06-03 12:49:00
-
추천
 추천하기 추천하기
-
조회수 3090
요약동물계에서 가장 풍부한 세포 외 매트릭스 단백질 인 콜라겐은 섬유질 단백질 군에 속하며, 조직에서 하중을 전달하고 세포에 대해 생체 적합성이 높은 환경을 제공합니다. 이 생체 적합성이 높기 때문에 콜라겐은 체외 테스트 시스템을위한 이식 형 의료 제품 및 발판을위한 완벽한 생체 재료가됩니다. 수술 및 치과 용 또는 세포 배양 매트릭스를위한 콜라겐 기반 용액, 다공성 스펀지, 막 및 실을 제조하기 위해, 포유 동물의 피부 및 힘줄로서 콜라겐 풍부 조직은 물리적 및 화학적 수단에 의해 집중적으로 처리된다. 심낭 및 장과 같은 다른 조직은 복잡한 collagenous 구조를 유지하면서보다 부드럽게 세포 제거됩니다. 조직 처리 기술은 일련의 단계로 구성됩니다. 이는 강도, 온도에 대한 안정성 및 효소 분해 및 세포 반응에있어서 다양한 특성을 갖는 구조적으로 다양한 재료를 제조하기 위해 상이한 방식으로 조합된다. 복잡한 구조는 결합 된 기술에 의해 달성됩니다. 멸균 단계와 다공성 구조의 준비를 통해 다양한 건조 기술이 동시에 수행됩니다. 화학적 가교는 방사, 성형 또는 첨가제 제조 기술로서 주조 단계와 결합된다. 콜라겐 기반 바이오 잉크를 사용하면 3D 구조로 형성되고 생세포와 결합하여 중요한 진전이 예상됩니다. 이 검토는 콜라겐이 풍부한 조직을 콜라겐 가수 분해물로 처리하는 기술 원리와 다른 모양의 제품을 재건하는 방법에 대한 개요를 제공합니다. 최종 재료 특성에 대한 처리 단계의 효과는 특히 열적, 물리적 특성 및 효소 분해에 대한 감수성과 관련하여 논의된다. 이러한 특성은 생물학적 및 임상 적 적용, 취급 및 대사를위한 주요 기능입니다. 소개2000여 년 전 초기 외과의 사는 이미 콜라겐 성분을 피부 나 내장으로 상처를 막고 재건 수술에 사용했습니다. 그러나 지난 50 년 동안 집중 청소 및 멸균 절차 기술이 개발 되었기 때문에 콜라겐을 의료 제품으로 더 자주 사용하게되었습니다 [ 1 ]. 상처 봉합, 화상 치료, 지혈, 탈장 치료, 뼈 및 연골 결손의 치료뿐만 아니라 유도 뼈 치료를 포함한 다양한 치과 응용 분야에 적용 할 수 있습니다 [ 2 , 3 , 4 ]. 조직에서 콜라겐은 스캐 폴드 물질로 생리 학적으로 활성이 높은 세포와 세포 성분에 최적의 환경을 제공합니다. 따라서, 최근의 발달은 장기 이식을위한 장기의 높은 요구를 극복하기 위해 조직 구조를 유지 한 후, 재세 포화를 유지하면서 장기 부분 또는 전체 장기의 탈세 포화에 초점을 맞추고있다. 살아있는 세포와 결합 될 수 있고 3D 구조로 형성된 콜라겐 기반 바이오 잉크를 사용함으로써 중요한 진전이 예상된다. 지난 수십 년 동안 많은 리뷰는 콜라겐이 구조 형성 물질로서 중요한 역할을하기 때문에 생체 물질로서 콜라겐의 다른 응용을 요약했다 [ 2 , 3 , 5 , 6 , 7 , 8 , 9 ]. 약물 전달 시스템 [ 4 , 10 , 11 ], 조직 공학용 매트릭스 [ 12 , 13 ], 국소 hemostyptics [ 14 ], 연조직 복구 용 [ 15 ] 및 다양한 응용을위한 막으로 사용됩니다 [ 16 , 17]. 최근의 기여는 기술적 인 측면을 검토했지만 주로 장기 및 조직 탈세 포화를위한 것이었다 [ 18 , 19 , 20 , 21 , 22 , 23 , 24 , 25 ]. 이 검토는 콜라겐이 풍부한 조직을 콜라겐 가수 분해물로 처리하는 원리, 다른 모양의 물질의 재건 및 처리 단계가 최종 물질 특성, 특히 열적, 물리적 특성 및 효소에 대한 감수성에 미치는 영향에 대한 개요를 제공합니다. 하락. 이러한 특성은 임상 처리 및 분해 행동의 주요 특징입니다. 이것은 장기 탈세 포화의 기술적 진보와 관련하여 더욱 중요하다. 새로운 구조가 더 작은 단위로 재건되는 구조와 적층 제조를 저장하는 것을 목표로한다 [ 26 ]. 콜라겐 처리 기술은 일련의 단계로 구성됩니다. 형상, 역학, 생리 학적 행동 및 취급과 관련하여 다양한 특성을 갖는 구조적으로 다재다능한 재료를 제조하기 위해 여러 단계가 다른 방식으로 결합됩니다. 가공은 콜라겐 구조를 유지하거나 집중적 인 화학적, 기계적 및 물리적 처리에 의해 영향을받을 수 있습니다. 섬유 재 조립 및 성형을 통해 새로운 구조를 생성 할 수 있습니다. 조직을 처리하기위한 다양한 처리 단계는 최종 특성에 대한 이러한 단계의 영향을 논의하고 고체 또는 액체 형태의 의료 및 제약 응용 분야에서 사용될 수있는 다양한 ECM 파생 구조의 놀이터 역할을하기 위해 요약됩니다. 2D 또는 3D 구조를 제조 할 수 있습니다. 의료용 콜라겐 원료 및 공급원많은 콜라겐이 풍부한 조직은 외과 적 목적으로 의료용 제품을 제조하는 원료로 사용됩니다 (예 : 치과 치료 및 기타 응용 분야에서 상처 치유를 지원하기위한 연조직 확대). 일반적으로 피부, 심낭, 소장, 방광 및 힘줄이 적용됩니다 [ 27]뿐만 아니라 뼈, 근막, 심장 판막 등과 같은 많은 다른 조직들. 힘줄 및 뼈 이외에, 이들 조직 전부는 상이한 비 섬유질 물질, 세포 및 세포 성분과 관련된 섬유질 단백질의 층 상화 된 조성물로서 기술 될 수있다. 그들의 기능에 따라 조직은 층으로 구성됩니다. 이들 층은 기계적 힘을 취할 수 있거나 또는 세포로드가 높은 조직의 대사 부분으로서 작용한다. 대사 층은 화학 분자 또는 세포 성분을 분리 또는 수송하는 역할을하는 막 활성을 나타낸다. 생의학 회사는 사람이나 동물로부터 얻은 조직으로부터 임플란트를 제조합니다. 조직은 정제되고 종종 여러 가지 방식으로 처리됩니다. 표 1 은 구조, 가교 기술, 조직 공급원 및 종 및 멸균 기술이 다른 선택된 제품을 요약합니다. 보다 포괄적 인 컬렉션은 다른 저자에 의해 출판됩니다 [ 27 , 28 , 29 , 30 , 31]. 최근의 조사는 장기 및 장기 부분의 세포를 제거하는 원리를 설명했는데, 이는 세포를 다시 세포 화해야하지만 그러한 제품은 아직 시장에 출시되지 않았습니다. 다음 섹션에서는 의료 제품을 준비하기 위해보다 집중적 인 기술 치료가 필요한 가장 일반적인 조직의 조직 학적 이미지와 프로세스 중에 저장되는 조직의 일부가 설명됩니다. 피부척추 동물의 피부는 몸 전체를 감싸고 환경 영향으로부터 보호합니다. 오랫동안 피부는 가장 큰 기관으로 논의되어 왔지만 [ 32 , 33 ] 체중이나 면적에 따라 이것은 사실이 아닌 것 같습니다 [ 34 ]. 그러나 피부는 넓은 면적의 최종 재료로 쉽게 옮길 수있는 기관입니다. 포유류에서 피부는 표피, 진피 및 피하층으로 구성됩니다 (그림 1 ). 12-20 세포 표피 층을 가진 두껍고 고도로 각질화 된 피부는 신체의 높은 인열 (손바닥, 발바닥), 얇은 피부 (2-4 세포 층)가 신체의 나머지 부분을 덮고있는 부위에서 발견됩니다. 두꺼운 피부의 표피는 각질층, 각층 스피노 섬, 각질 과립 및 각질층의 4 개의 층으로 세분된다. 기저층 (stratum basale 또는 germinativum)은 진피에 인접한 콜라겐 IV로 구성된 기저막상의 유사 분열 활성 각질 세포로 구성되어있다 [ 35]. 다른 레이어는 다른 상태의 셀로 구성됩니다. 가장 바깥층 인 각질층은 각질화되고 불완전한 핵이없는 세포로 구성됩니다. 피부색은 신경 능선에서 유래 한 멜라노 사이트에 의해 생성되고 기저층에서 발견되는 안료에 의해 발생합니다 [ 32 , 36 ]. 그림 1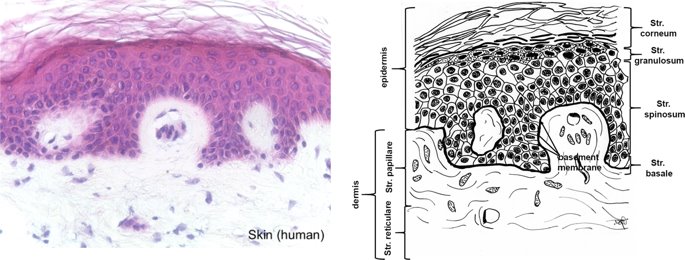 인간 피부의 조직 학적 절단 (왼쪽) 및 해당 도면. 진피의 표피층 및 세포 성분은 진피의 구조적 성분을 절약하면서 처리 동안 제거된다. (모든 조직 학적 그림과 그림은 Gundula Schulze-Tanzil, Institut für Anatomie, Paracelsus Medizinische Privatuniversität (PMU), Salzburg 및 Nürnberg, Nürnberg, Germany)에 의해 친절하게 공급되었습니다. 진피는 유두층 (Str. papillare) 및 망상 층 (Str. reticulare)으로 서브 클래 싱된다. 유두층은 진피-표피 접합부에서 유두를 형성한다. 이 유두는 접합 영역의 표면을 증가시키고 층의 접착력을 향상시킵니다. 모낭은 유두층으로 확장됩니다. 그들은 표피에 직면하고 전구와 모근을 포함합니다. 전구 세포는 모발을 형성하기 위해 증식합니다. 표피는 구조 단백질 각질로 구성되어 있지만, 진피는 주로 엘라스틴 섬유와 부분적으로 공존하는 콜라겐 섬유로 만들어집니다 [ 37 ]. 또한, 섬유질 조직은 다량의 물에 결합하여 섬유 사이의 공간을 채우는 다양한 거대 분자 (히알루 론산, 데르 마탄 설페이트, 콘드로이틴 설페이트, 피브로넥틴, 테나 신, 에피 모르핀 등)의 혼합물을 함유한다 [ 33 ]. 피하 조직은 콜라겐 섬유와 관련 성분, 특히 엘라스틴 및 지방 조직의 혼합물을 함유하고 있으며, 영양이 풍부한 동물의 피부 아래에 층이 될 수 있지만 진피에 대한 통찰력을 제공하는 유두 형태로 조직 될 수도 있습니다 (예 : 진피에 대한 통찰력 제공) 돼지 피부). 피하의 콜라겐 섬유는 진피의 콜라겐 섬유와 섞여 있습니다. 피부에는 또한 다양한 땀샘 (땀, 악취, 피지), 근육 (예 : 근육 유인 제 필리), 신경, 수용체 및 세포가 포함됩니다. 피부의 섬유 배향은 동일한 종의 다른 동물의 피부의 면적, 단면 및 피부 사이에서 균일하다 [ 38 , 39 , 40 ]. 피부는 랑거 라인 (± 10 °)을 따라 관찰되고 콜라겐 섬유의 수동적 장력에 의해 야기되는 내부 장력을 나타낸다. 장력이 가장 낮은 가장 균일 한 부분이 허리를 덮고있는 중앙 영역에서 발견됩니다. 복부 영역과 말단은 프리스트레스가 높고 훨씬 더 탄력적입니다 [ 41 , 42 ]. 더욱이, 피부의 기계적 구성은 종과 나이 그리고 아마도 다른 요인들에 의존한다 [ 40 , 41 , 42]. 정제 절차는 보통 표피와 피하를 제거합니다. 원료의 두께에 따라 진피는 유두층을 포함하는 입자 부분과 주로 망막으로 구성된 부분으로 나눌 수 있습니다. 심낭심낭은 심장의 형태로 심장을 완전히 덮습니다. 그것은 3 개의 층과 추가로 주변 지방 조직과 후자를 덮는 세로 자로 구성됩니다 (그림 2 ). 심낭 막 섬유종은 심장이과 팽창되는 것을 막고 P. 혈청은 두 층으로 더 나뉘어집니다. Lamina parietalis는 P. fibrosum에 단단히 부착되어 있으며 Lamina visceralis (미도시)는 미끄러운 액체 층에 의해 다른 lamina와 분리되어 있으며 심근을 덮고있다 [ 43 ]. P. fibrosum과 L. visceralis는 콜라겐과 탄성 섬유로 구성되어있다 [ 44 ]. 특히 피. 피 브로 섬에서 콜라겐 섬유는 고도로 배향되어있다. 그러므로 기계적 안정성은 균일하게 분포되지 않지만 조직은 이방성으로 작용한다 [ 45]. 탈세 포화는 세로 사 및 지방 조직을 제거한다 [ 46 ]. 그림 2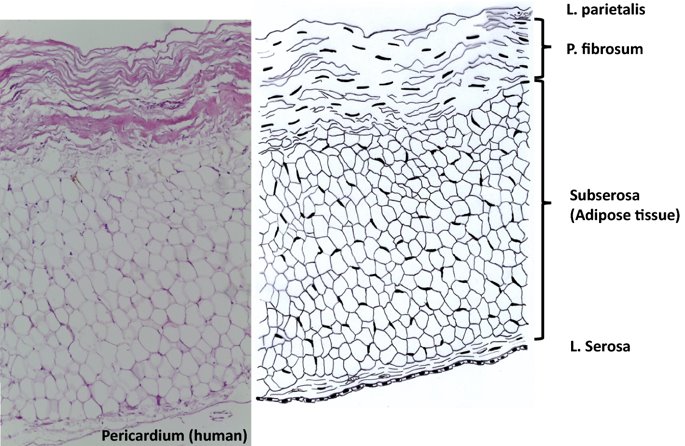 인간 심낭의 조직 학적 절단 (왼쪽) 및 해당 도면. 처리하는 동안 P. fibrosa 만 저장됩니다 장소장은 내강으로 시작하는 5 개의 층으로 구성됩니다 (그림 3 ) : Laminae mucosae (3 laminae), submucosa, L. muscularis transversalis, L. muscularis horizontalis and L. serosae [ 47 ]. 탈세 포화 동안 점막하 근육 근 부분의 부분 만이 지속됩니다. 다른 레이어는 완전히 제거됩니다. 그림 3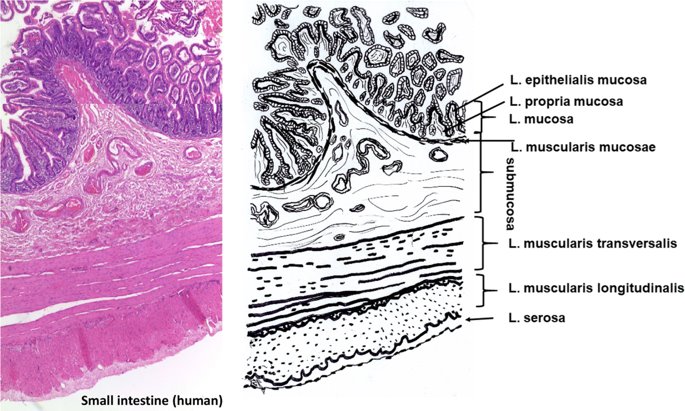 인간 소장의 조직 학적 절단 (왼쪽) 및 해당 도면. 처리는 점막하 및 근육 횡경막의 부분을 저장합니다. 점막, 근육종 및 세로 사 제거 방광장과 유사하게, 방광 조직은 복막의 일부로서 Laminae mucosae, submucosa, three muscularis layer 및 L. serosa (도시되지 않음)로 형성된다 [ 47 ] (도 4 ). 정제 동안 결합 조직 (점막하)은 저장되는 반면 비 콜라겐 부분은 기계적 및 화학적 수단에 의해 분리된다. 그림 4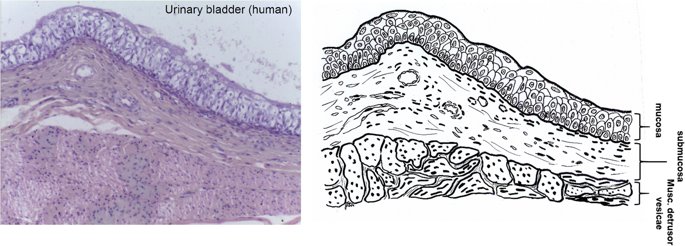 인간의 방광의 조직 학적 절단 (왼쪽)과 해당 그림. 처리는 점막하 만 저장합니다 건힘줄 (그림 5) 근육에서 뼈로 기계적 하중을 전달합니다. 따라서 힘줄은 당김 방향으로 높은 기계적 힘을 견뎌야합니다. 이들은 백색이며 섬유 다발 사이에 적은 수의 세포 (테드 셀, 힘줄)를 갖는 섬유질 질감을 나타낸다. 힘줄은 에피 테 논과 망막과 (연골 피복 바닥), 풀리 및 시스 (sheath)와 같은 다양한 구조로 둘러싸여 있으며, 휴식 및 적재 상태에서 해부학 적으로 올바른 위치를 유지합니다. 이러한 주변 구조의 수와 모양은 다른 힘줄 (예 : 아킬레스 힘줄 또는 손가락과 발 힘줄)에 따라 다릅니다. 활막 외피, bursae 및 paratenon은 힘줄과 뼈의 환경 사이의 마찰을 감소시키는 부분적으로 섬유질 구조입니다. 얇은 횡단, 경사, 8-10 nm의 종 섬유는 각각 하나의 전체 힘줄을 둘러싼 다. 엔도 논은 섬유 다발을 커버하고 함께 묶으며 다발의 상호 활공을 가능하게한다. 그것은 전형적인 열 십자형 패턴을 갖는 망상 결합 조직 및 고도로 수화 된 글루코 사 미노 글리 칸으로 구성된다. 엔도 테논은 혈관, 신경 및 림프액에 산재되어 기저 콜라겐 조직을 제공합니다. 그림 5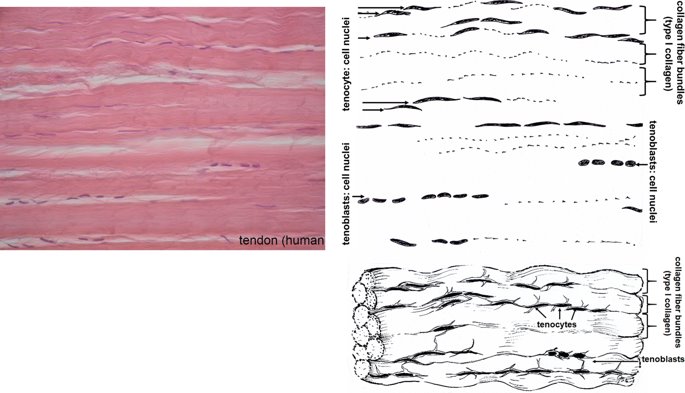 인간의 힘줄 및 해당 도면의 조직 학적 절단 (왼쪽). 섬유 다발은 엔도 테논 층으로 덮여 있으며, 에피 텐온에 의해 완전한 힘줄 (보이지 않음)이다. 처리하는 동안 완전한 세포 구성 요소 (tendoblasts 및 tendocytes)를 제거해야합니다 힘줄의 근막에있는 콜라겐 섬유는 세로 방향으로 가로 지르고 가로로 가로 지르며 서로 교차합니다. 따라서, 하중은 길이 방향으로 완충 될 수 있지만, 어느 정도 가로, 수평 및 회전 이동이 전달된다. 힘줄 구조 (섬유, 섬유, 소 근막, 근막)의 서로 다른 레벨의 정확한 크기를 정의하는 것은 합리적이지 않습니다. 이러한 크기는 예를 들어 해부학, 종 및 아마도 개인의 변화에 따라 다양하기 때문입니다 [ 48 , 49 , 50 ]. 재조합 소스현재 생체 물질의 콜라겐은 인간의 공여자 또는 이종 발생원, 주로 소, 돼지 또는 말에서 추출되며, 이러한 생물학적 공급원으로부터 콜라겐을 얻는 것이 표준으로 남아 있습니다. 콜라겐 및 콜라겐 펩타이드는 또한 대장균 , 효모, 포유류 세포 배양, 곤충 및 식물과 같은 유전자 도입 유기체로부터 생산되어왔다 [ 11 , 51 , 52 ]. 높은 가격과 관련이있는 낮은 수율은 사용을 제한하고 왜 그러한 소스가 아직 대안으로 확립되지 않았는지 설명합니다. 둘째, 적절한 양의 Pro 및 Lys의 하이드 록 실화, 글리코 실화 및 이종삼 량체 조성물과 같은 번역 후 변형은 완전히 해결되지 않은 과제이다 [53 , 54 ]. 따라서 향후 몇 년간 콜라겐 기반 생체 재료를 제조하는 주요 원천은 동물 원천으로 남아 있습니다. 콜라겐 조성, 형성, 구조, 안정성 및 특성콜라겐은 동물 유래 섬유 성 당 단백질 패밀리를 포함한다. 다른 콜라겐 유형의 구성과 그로 인한 다양한 구조는 전 세계 거의 1 세기의 연구원들로부터 연구 주제였습니다. 많은 사람들이 콜라겐에 대한 기본 지식과 다양한 구조의 다른 조직에서 최종적으로 생성되는 다양한 복잡한 구조를 구축 할 때의 다목적성에 대해 요약했기 때문에 이것은 본 검토의 핵심 주제가되지 않을 것이다 [ 55 , 56 , 57 , 58 , 59 , 60 , 61 , 62 , 63]. 그러나 짧은 요약은 기계, 열 및 화학 기술에 의한 콜라겐 처리와 관련하여 중요한 것으로 보이는 몇 가지 주요 특징을 제시합니다. 콜라겐 타입척추 동물에서, 콜라겐은 적어도 45 개의 상이한 유전자에 의해 코딩 된 28 개의 상이한 유형을 설명한다. 콜라겐은 결합 조직의 주요 구조 성분입니다. 특히, 힘줄, 뼈, 피부 및 연골과 같은 내력 조직에서 로프와 같은 단백질은 하중 전달을 가정합니다. 이 조직에서는 소수의 콜라겐 유형 만 지배합니다. 콜라겐 타입 I은 덜 빈번한 타입 III 및 V 외에 피부, 힘줄 및 뼈에서 가장 풍부한 콜라겐이다. 연골은 주로 타입 II 콜라겐으로 구성된다. 그러나 콜라겐은 거의 모든 조직에서 발견됩니다. 다른 유형은 네트워크 나 진주 끈처럼 배열되며, 일부 유형 (FACIT)은 원 섬유 형성 유형과 적은 양으로 연관되며 다른 유형은 막의 일부로 발견된다 [ 55 , 64 , 65] (표 2 ). 표 2 다양한 콜라겐 유형이 다양한 상부 구조로 구성되어 있습니다.풀 사이즈 테이블 모든 콜라겐은 동일하거나 매우 유사한 폴리펩티드 사슬에 의해 형성되는 동종 또는 이종삼 량체를 형성하는 삼중 나선으로 적어도 부분적으로 구성된다. 일반적으로 하나의 콜라겐 분자는 단량체로 명명되고, 삼중 나선은 중합체 화학에서의 명명법과 대조적으로 콜라겐 분자 [ 66 ]로 불리며 , 여기서 단량체는 중합 전 최소 단위, 예를 들어 에틸렌 / 폴리에틸렌 또는 락트산 / 폴리 락트산이다. 콜라겐 분자의 모든 삼중 나선 부분의 주요 주제는 X 및 Y가 각각 21 개의 아미노산 중 하나 인 3 번째 위치 (Gly-X-Y) n 에서 반복되는 글리신 이다. 다양한 조직 및 종의 상이한 콜라겐 제제의 아미노산 조성은 단지 약간의 변화를 보여준다 (표 3 ). Cys, Met (환원 / 산화), Gln, Asn (알칼리 처리) 또는 Lys 및 Hyl과의 반응 (화학 가교)과 같은 일부 아미노산에 영향을 미치는 화학 처리의 특정 작용은 해당 장에서 설명합니다. 글리신 (Gly)은 가장 작은 아미노산이며 수소 원자 측쇄는 항상 삼중 나선 중심의 위치를 차지하지만 X와 Y는 종종 프롤린 및 히드 록시 프롤린이며 측쇄는 중심 축에서 돌출됩니다. 포유 동물 콜라겐의 Y 위치에서 거의 모든 프롤린 (Pro) 및 일부 라이신 (Lys)이 하이드 록 실화된다. 피부에서, 알파 쇄당 이들 하이드 록시 리신 중 2 개는 삼중 나선 형성 전에 추가로 효소 적으로 글리코 실화된다. 이 글리코 실화는 조직 특이 적이며, 예를 들어 피부 또는 힘줄보다 각막 또는 연골의 콜라겐에서 훨씬 높다 [ 67 , 68 , 69 ]. 트리플 나선 형성삼중 나선으로 단일 프로토 콜라겐 사슬의 완전한 조립은 콜라겐 형성 및 복잡한 세포 내 절차의 주요 단계이다. 트리머 화는 체인의 C- 말단에서 시작하며, S- 이중 결합에 의해 고정되고 각 체인의 동일한 방향으로 지퍼 모양으로 진행됩니다 (그림 6 스키마). 이는 상이한 콜라겐 사슬의 혼합물 및 배향을 조절하는 추가적인 구형의 비-콜라 게 노스 도메인에 의해 개시된다. 삼량 체화 후 프로 펩타이드는 절단된다 [ 49 , 70 , 71 , 72 ]. 그림 6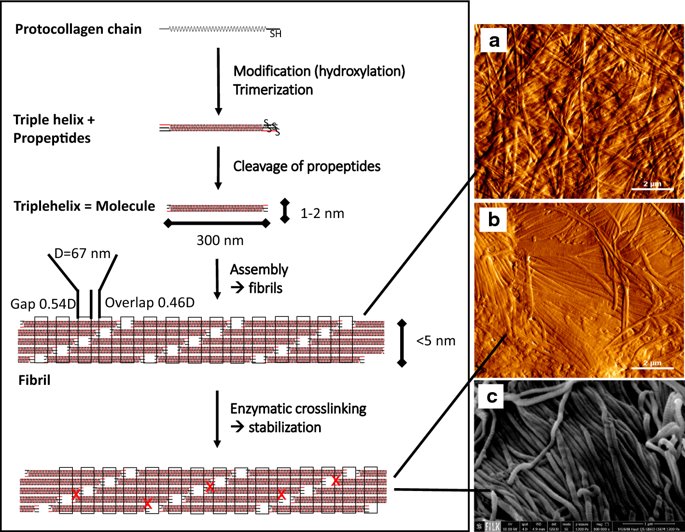 스키마 : 모노머 프로토 콜라겐 사슬은 삼량 체화되고, 프로 펩티드는 절단되고 콜라겐 분자는 마이크로 피 브릴 및 피 브릴에 자기 조립된다. 라이 실옥시다 제에 의한 라이신 및 히드 록시 리신의 산화는 다양한 천연 효소 유래 가교 결합의 형성을 개시한다 [ 62 , 508 ]. 재 조립 된 콜라겐 (건조) 의 원자력 현미경 이미지 (AFM); b 건조 된 돼지 피부 분열의 AFM 이미지 및 c 주사 전자 현미경 이미지 (건조). AFM 및 REM 이미지는 Diana Voigt와 Ralf Bittmann, FILK에 의해 작성되었습니다. 삼량 체화는 트랜스 배열에서 모든 아미노산을 요구한다. 이미 노산 프롤린 및 히드 록시 프롤린의 시스 형태가 에너지 적으로 선호되기 때문에, 효소 적으로 강화 될 것으로 추정되는 이성 질화가 필요하다 [ 65 , 73 ]. 변성 된 비 삼중 헬리컬 콜라겐에서 16 %의 X-Pro 및 8 %의 X-Hyp이 시스 구성 인 것으로 밝혀졌다. 삼량 체 형성은 시스-트랜스 이성 질화보다 1000 배 빠르기 때문에이 이성 질화는 콜라겐 삼량 체화의 속도 제한 단계이다 [ 74 ]. 체외 변성 콜라겐은 부분적으로 삼중 나선 구조로만 재 조립됩니다. 핵 형성은 이미 노산이 시스 구성 인 다른 위치에서 무작위로 시작된다 [ 75 ]. 섬유소 조립 및 고층 구조물의 형성용매 콜라겐 분자는 용매 분자의 손실에 의해 야기되는 엔트로피 구동 공정에 의해 원 섬유로 조립되며, 이는 에너지 적으로 최소화 된 면적 / 부피 비율로 이어진다 [ 59 ]. 생체 내 피 브릴은 공간적으로 분해 된 조직 및 상이한 콜라겐 유형의 정의 된 화학량 론 (예를 들어, 유형 I과 조합 된 III 및 V)을 보여준다. 이들의 조립은 피브로넥틴, 인테그린 및 마이너 콜라겐과 같은 추가 분자 조직에 의해 세포 적으로 효소 적으로지지되는 것으로 생각된다 [ 60 ]. 시험 관내 버퍼링 용액에서, 중성 pH 및 온도> 20 ℃에서, 포유류 콜라겐은 마이크로 피 브릴 및 피 브릴로 조립되어 전자 현미경 및 원자력 현미경 이미지에서 관찰되는 전형적인 교차 줄무늬를 초래한다 (도 6a -c). 일탈 조건 (pH ≠ 중성, 다른 염, 유기 용매)에서 콜라겐 분자는 무질서한 구조에서 흰색 또는 투명한 침전물로 고형화됩니다. 자연 가교콜라겐은 내부 및 간 삼중으로 가교된다. 자연 가교는 2 가지 상이한 메커니즘에 의해 형성된다. 하나는 효소 적으로 제어되어보다 복잡한 안정된 가교에 자발적으로 반응하는 특정 2가 생성물로 이어진다. 효소 적으로 조절 된 가교는 다른 조직들에 따라 다르다 [ 76]. telopeptidal 리신의 ε-aminogroup은 lysyloxidase에 의해 carbanion으로 산화 된 다음, telopeptides의 lysine을 aldimines dH-HLNL (dehydro-hydroxylysinonorleucine)과 나선 부위에서 dH-LNL (dehydrolysinonorleucine)로 반응합니다. 이러한 쉬프 염기는 생리 학적 조건 하에서 안정하지만 산성 절단에 취약하다. 또한, 성숙 동안 dH-HLNL은 히스티딘과 화학적으로 안정한 히스 티 디노-히드 록시 리 시노 노르 루신 (HHL)에 반응한다. Telopeptidal hydroxylysine은 Amadori 재 배열을 거친 Schiff 염기에 반응하여 콜라겐 분자의 비-나선 부분에서 안정적인 ketoimines hydroxylysino-5-ketonorleucine (HLKNL)을 형성하고, 각각에서 Lysine-5-ketonorleucine (LKNL)을 형성합니다. 나선형 부분. 알디 민은 피부와 힘줄에 우세합니다. 두 번째 메카니즘은 포도당 및 그 산화 생성물과 상관 관계가있는 다수의 다른 자발적인 비특이적 반응을 포함하여, 진보 된 당화 최종 생성물 (AGE)을 초래한다 [ 77 ]. 이들 AGE는 조직 및 기관의 노화 메커니즘, 및 당뇨병과 같은 질병과 관련하여 점점 중요 해지고있다 [ 76 , 78 , 79 , 80 , 81 , 82 , 83 , 84 , 85 , 86 ]. 포도당, 리보스 및 기타 당 및 당 산화 생성물은 라이신, 히드 록시 리신 및 아르기닌과 반응하여 소수만이 지금까지 특징 지어진 복잡한 생성물을 형성한다 [76 , 87 ]. 성숙 된 효소 적으로 유도 된 가교 결합 및 비 효소 적 가교 결합은 노령 동물 및 인간으로부터의 조직의 완충액 및 약산에서 콜라겐의 낮은 용해도를 유발한다. 그들은 효소 및 화학적 절단에 대해 매우 안정적입니다. 이는 용해 동안의 수율, 처리 시간 및 사용되는 화학 물질의 종류로서 추가 처리에 직접적인 영향을 미칩니다. 엘라스틴엘라스틴은 일반적으로 콜라겐과 관련된 원 섬유 형 단백질입니다. 그것은 특히 혈관, 인대 및 피부에서 어느 정도 다른 농도로 발견됩니다 [ 47 , 88 , 89 ]. 언급 된 조직에서 엘라스틴의 함량은 토폴로지에 따라 변한다. 오름차순 대동맥에서 엘라스틴 함량은 내림차순 대동맥보다 높으며 [ 47 ] 피부에서 그 함량은 곡물과 살측 에서 다양하다 [ 90 ]. 최대 70 % 엘라스틴의 농도는 소와 말의 인대 누에에서 발견됩니다 [ 91 ]. 낮은 하중 조건 하에서 결합 조직의 복구를 보장하고 실패없이 수십억 개의 굴곡을 견뎌냅니다 [ 13 , 92, 93 ]. 엘라스틴은 72 kDa 트로포 엘라스틴 분자로 구성된다. 블록 공중 합체와 유사하게, 이들 분자는 세포로부터 직접 압출 한 후 코아세르베이트하는 소수성 블록과 리신을 포함한 데스 모신 및 이소도 모신 가교에 대한 효소 적 제어에 의해 가교되는 친수성 블록으로 구성된다 [ 94 ]. 가교는 가수 분해에 대해 생성 된 네트워크를 고도로 안정화시킨다. 뚜렷한 변성 온도를 나타내는 삼중 나선 콜라겐과 달리, 엘라스틴은 완전히 수화 된 상태의 유리 전이 온도가 30 ° C입니다 [ 95 ]. 콜라겐 구조가 저장되는 동안 엘라스틴은 특정 엘라 타제에 의해 분해 될 수있다 [ 96]. 대조적으로, 엘라스틴-풍부 조직을 예를 들어 뜨거운 0.1 N 수산화 나트륨으로 50 분 동안 처리함으로써 순수한 엘라스틴을 추출하고 다른 단백질을 분리하는 것이 가능했다. 이것은 단지 하나의 가능한 방법이며 다른 것, 예를 들어 포름산에서 BrCN으로 처리하는 방법도있다 [ 97 ]. 오랫동안, 엘라스틴은 조직을 정제하는 동안 "오염시키는"성분으로서 허용되었지만, 구체적으로 제거되지는 않았지만, 최종 용도를 전혀 고려하지 않았다. 한편으로는 정확한 엘라스틴 함량을 제어하기가 어려웠고, 한편 엘라스틴은 분해에 대해 매우 안정적이며, 복합 재료의 기계적 손상을 방지해야한다. 최근의 개발 은 신생 혈관 형성을 개선 하기 위해 상처 수축을 방지하기 위해 탄성 성분으로서 엘라스틴을 추가하고 (Matriderm ® ), 또한 엘라스틴은 유일한 생체 물질로서 사용되도록 제안되어있다 [ 13 , 94 , 98 ]. 섬유 구조, 방향 및 기계적 안정성힘줄 섬유, 특히 쥐의 섬유질은 인대 섬유 또는 장 및 피부보다 제조하기 쉽고 훨씬 균일하다. 따라서, 과거의 많은 초 미세 구조 연구는 조직 또는 재 조립 된 가용성 콜라겐과 같은 조사 된 래트 꼬리 힘줄 콜라겐에 초점을 맞추었다. 그러나 광범위한 조직에 대한 일부 조사에 따르면 섬유질 직경과 분포는 연령, 조직, 피부와 같은 성층화 된 조직의 층 및 종에 따라 달라진다 [ 99 , 100 , 101 ]. 콜라겐 섬유의 주요 공지 기능 중 하나는 기계적 하중을 인계하는 것이다. 섬유 분포의 조성은 섬유가 크리핑 (작은 직경, 예를 들어 폐, 신경 또는 각막) 또는 고하 중 (큰 직경의 힘줄)을 전달할 수 있는지를 결정합니다 [ 102 ]. 섬유는 우선적으로 기본 하중지지 방향으로 정렬되며 가능한 하중을 예상합니다. 따라서, 방향이 조직 및 종에 따라 다른 섬유의 직경은 조직 안정성에 중요한 역할을한다 [ 40 , 103 , 104 , 105 ]. 포유 동물 피부에서 진피 내의 섬유는 랑거 라인에 따라 배향된다. 콜라겐 섬유 다발은 얇은 탄성 섬유로 연결되어있다 [ 106 , 107 , 108 , 109 , 110 , 111 ]. 피부의 콜라겐 섬유 네트워크는 배쪽과 비교하여 뒤쪽이 더 밀도가 높습니다. 섬유 다발의 두께의 큰 차이는 유두와 망막 사이에서 관찰된다 [ 33 , 35 , 112 ]. 피부가 의료 기기의 원료로 사용되는 경우,이 불균일성은 샘플링 위치 및 섬유 방향에 따라 다른 기계적 안정성을 유발합니다. 힘줄의 콜라겐 섬유는 주로 가로 및 가로로 세로 및 훨씬 더 낮은 방향으로 배향된다. 종 방향 피 브릴은 서로 교차하여 나선과 엮기를 형성한다. 그것들은 이동 중에 종 방향으로 그리고 어느 정도 가로, 가로 및 회전력을 완충 할 수있다 [ 50 ]. 또한, 건 콜라겐 섬유는 균일 한 피부 섬유와 대조적으로 크림 핑된다. 소장 점막하 (SIS)는 세로 방향의 섬유를 보여 주며, 심낭의 섬유와 방광은 국소 적으로 배향되어 있지만 더 큰 영역에는 있지 않습니다 [ 45 , 113 , 114 ]. 기계적 안정성이 생성되는 구조적 수준에 대해서는 여전히 집중적으로 논의되고있다. collagenous 조직의 응력-변형 곡선은 일반적으로 S 자 모양입니다 [그림. 7 ; (1) ~ (4)]. 몇몇 저자 [ 115 , 116 , 117 ]는 곡선의 각 부분이 상이한 구조적 레벨에서 상이한 구조적 효과를 반영 함을 보여줄 수있다. 그림 7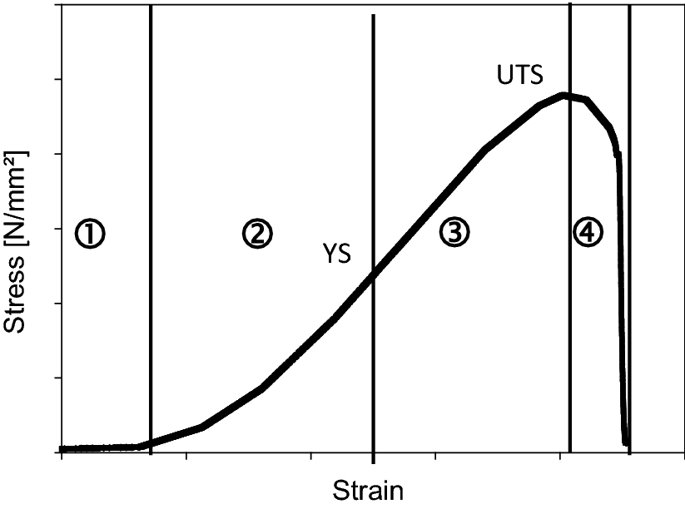 콜라겐 조직의 전형적인 응력-변형 거동 (자체 측정 값)의 예로 젖은 돼지 가죽 중간층의 응력-변형 곡선. ① 발가락 부위 : 섬유와 섬유소 크림프가 똑 바르게되고 (힘줄) 섬유가 정렬됩니다 (피부). 갭 오버랩 비율 증가; 재설정은 엘라스틴 섬유에 의해 야기된다; ② 탄성 영역 : 탄성 섬유가 변형되고 섬유, 피 브릴 및 마이크로 피 브릴이 서로 미끄러지기 시작합니다. 미세 섬유 슈퍼 트위스트는 가교에서 토크 전달을 일으킨다. 분자가 늘어나고 전단되기 시작합니다. ➂ 소성 영역 : 조직이 생성되기 시작합니다. 계면 박리; 플라스틱 섬유는 서로 변형되어 미끄러 져 움직입니다. 얽힘의 부분적인 붕괴; 결합 수 배출; 나선이 풀리고 서로 미끄러집니다. ④ 파열 : 조직이 층을 박리 (피부)하고 파괴합니다. 섬유, 피 브릴 및 마이크로 피 브릴은 제세동, 파괴 및 인출; 분자들 사이의 가교는 파괴된다. YS, 수율 변형; UTS, 최고의 인장 강도; [116 , 509 ] 이러한 곡선 (1)의 발끝에서 발끝까지 전체 구조는 낮은 변형률로 곧게 펴집니다. 콜라겐 분자의 네트워크는 예를 들어 피부에 평행하게 배열된다. 힘줄과 심낭에서는 지그재그 모양의 평행 배향 분자가 길어집니다. 섬유, 피 브릴 및 분자와 같은 모든 구조적 수준의 꼬임이 추출됩니다. 엘라스틴 네트워크는 에너지를 저장하고 언 로딩 후 재설정한다 [ 41 , 116 , 118 , 119 ]. 탄성 변형 (2) 동안 변형이 증가하면 경사가 선형이되고 콜라겐이 적용된 힘을 대신합니다. 콜라겐은 엘라스틴 네트워크가 과부하되는 것을 방지하고 콜라겐 섬유의 탄성 영역에 의해 에너지를 저장합니다. 특성은 다른 것들 중에서 프로테오글리칸에 의해 조절되는 섬유 조성 및 구조에 의존한다 [ 120 , 121 ]. 더 높은 하중은 콜라겐 분자가 서로에 대해 미끄러지도록하고 (3), 섬유는 신장되어 D- 밴드의 변형을 일으킨다. 마지막으로, 섬유와 가교가 갈라지기 시작합니다 (4). 조직 (예 : 피부)에 따라이 균열은 종종 층에서 관찰되는데, 모든 층이 동일한 탄성을 나타내지는 않기 때문입니다. 장력 측정 동안 장력 곡선은 급격히 감소하지 않고 약간 진동하면서 단계적으로 감소합니다 [ 42 , 104 , 115 ]. 결합 조직의 물리적 안정성은 섬유 단백질의 네트워크에 의존합니다. 수화 된 조직에서, 가교 밀도 (환원성, 성숙한 가교)는 조직이 더 부서지기 쉬운 지 또는 크리핑 할 수 있는지를 결정한다 [ 102 ]. 화학 작용제에 의해 특히 도입 된 합성 가교는 습윤 상태에서 조직을 추가로 안정화시키는 것으로 알려져있다 [ 122 , 123 , 124 , 125 ]. 최근에, 기계적인 거동의 컴퓨터 모델링은 점점 습식 및 건식 상태의 하중 하에서 콜라겐 분자 및 소 섬유의 거동을 모의 및 예측하기 위해 점점 더 사용되었다. 완전한 콜라겐 분자와보다 복잡한 높은 구조의 분자 동역학 시뮬레이션을 위해서는 여전히 컴퓨팅 능력이 충분하지 않기 때문에 데이터는 콜라겐 유사 펩티드를 기반으로합니다. 아미노산 서열은 단일 트로포 콜라겐 분자의 기계적 성질에 실질적으로 영향을주는 것으로 밝혀졌다. 이들 기계적 성질은 콜라겐 분자를 따라 균질하게 분포되지 않지만, 일부 영역에서만 하중 하에서 응력의 농도를 초래할 수있는보다 낮은 강성 블록 및보다 높은 강성 블록을 나타낸다. 이것은 또한 유전학, 생화학 및 생물 역학 사이의 연결 고리로 제안되었다.126 , 127 ]. 연성 및 강성 영역의 원리는 꼬임에 의해 반사 된 원 섬유 수준에서 다시 발견되며 [ 128 ] 피부에서 힘줄 또는 비평 행 섬유 방향으로 지그재그 형태로 조직 수준 에서 다시 발견된다 (위 참조). 따라서 이것이 ECM의 탄성 및 소성 특성을 조절하는 데 중요한 원칙이라고 가정 할 수 있습니다. 컴퓨터 모델링뿐만 아니라 AFM, 광 산란 및 X- 선 회절과 같은 다른 방법들도 콜라겐-유사 펩티드의 강성 및 인장 강도와 같은 기계적 특성을 계산하는데 사용되었다. 콜라겐 분자에 대해 ~ 5 ± 2 GPa의 강성이 발견되었으며, 젖은 상태에서 ~ 0.6 ± 0.2 GPa의 미세 섬유와 건조한 미세 섬유의 경우 3.3 (2–7) GPa [ 126 , 129 ]. Goh et al. [ 116]는 "결합 조직의 계층 적 역학"을 종합적으로 검토하고 콜라겐 피 브릴 및 콜라겐 분자와 비교하여 전체 조직의 물리적 특성을 요약 하였다. 문헌에서 수집 한 조직, 섬유 다발 (근막), 피 브릴, 마이크로 피 브릴 및 콜라겐 분자의 강성 및 항복 응력과 같은 기계적 가치는 모든 계층 적 수준에서 매우 넓은 범위 (50 ~ 100 % 평균 편차)를 나타 냈습니다 (표 4). 분명히,이 높은 편차는 다른 측정 조건과 고려 된 광범위한 조직으로 인해 발생합니다. 그러나,이 수집 물은 섬유 다발이 전체 조직보다 약간 더 유연한 가장 유연한 구조 단위라는 것을 보여준다. 그러나, 섬유 다발은 미세 섬유보다 4 배 덜 강하고 콜라겐 분자보다 20 배 덜 강성이다. 항복 강도에 대해 상이한 구조적 수준 사이의 유사한 요인이 또한 관찰되었다. 표 4 Goh et al.에 의해 요약 된 상이한 계층 레벨의 강성 및 강도 값. [ 116 ], Jain 1988에 의한 스폰지 [ 504 ], Koide 및 Daito에 의한 필름 [ 250 ], Pins et al. [ 503 ]풀 사이즈 테이블 콜라겐의 열 안정성콜라겐의 가공은 상이한 구조적 수준의 콜라겐의 열 안정성을 논의해야한다. 변성 온도를 T라고 전형적인 온도에서 삼중 나선의 언 커플 링 콜라겐 리드 가열 D 및 시차 주사 열량계 (DSC)에 의해 측정 할 수있다 (130) ]. T D 는 처리 상태 나 조직 수준의 콜라겐 물질이 다르다 [그림. 8 (1) 내지 (6)]은 효소 분해 거동, 습윤 상태에서의 기계적 안정성, 항원 특성 및 세포와의 상호 작용과 직접적으로 관련된다. T D 완전히 수화 수용성 콜라겐 (1)의 포유 동물의 체온 부근 [있다 131]. 절대 값은 포유류와 poikilotherms 사이에서 벗어난다 [ 132 ]. 온혈 동물의 수용성 콜라겐은 36 ~ 40 ° C의 변성 온도를 나타냅니다. Poikilotherms는 남극 얼음 물고기 나타내는 T 그들의 서식지로 조정 변성 낮은 온도, 예를 들면 냉수 물고기 수 D 6 ° C를. hydroxiproline 내용과 상관 T D 하고 콜라겐의 열 안정성은 프롤린 히드 록 실화 강도 [의해 조정되는 것으로 가정한다 (67) , 133 ]. 그림 8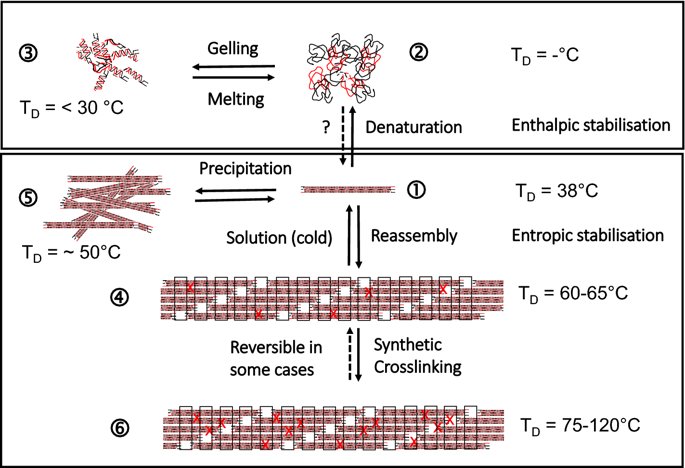 다른 재료 및 콜라겐 유도체 대응 변성 온도 T의 구조 D . (1) 가용성 콜라겐; (2) 젤라틴 용액; (3) 젤라틴 겔; (4) 재 조립 된 섬유질 콜라겐 / 조직; (5) 무질서한 침전 된 콜라겐; (6) 가교 된 (X) 어셈블리 / 조직; T D . 수축 온도 / 변성 온도 / 용융 (완전 수화) 삼중 나선 콜라겐 분자의 열 안정성은 구형 단백질의 열 안정성보다 현저히 높으며, 그 이유는 여러 해 동안 논쟁의 여지가있어 논쟁의 여지가있다 [ 62 , 134 , 135 , 136 , 137]. 수소 결합, 정전기 상호 작용, 반 데르 발스 상호 작용뿐만 아니라 소수성 상호 작용 및 스테레오 일렉트로닉 효과와 같은 삼중 나선의 안정화 원리에 대해 많은 다른 아이디어가 공식화되었지만 수소 결합의 사다리가 내부적으로 완전히 안정화된다는 것이 일반적으로 인정됩니다 수화 콜라겐 삼중 나선 약 1/5. 20 세기 중반 X 선 회절 연구와 추가 생화학 적 및 물리 화학적 연구에 따르면 이러한 안정화 결합은 글리신의 NH (Gly)와 다음의 X 위치에서 다른 아미노산의 C = O 사이에 위치 함 가닥 [ 138 ]. 삼중 나선은 삼중 나선의 열 안정성을 높이고 높은 변성 엔탈피 ΔH D [ 137 , 139 , 140 ]를 지원하는 물 분자 네트워크로 둘러싸여 있습니다. T로서 D 또한 ΔH D는 열량계로 측정 될 수 있으며, 이는 ΔH 것으로한다 D는 T 동안 직접적으로 수소 결합의 수를 반영 D는 엔트로피 적 및 콜라겐 삼중 나선의 안정성에 enthalpic 기여를 반영한다. T에 대한 정확한 enthalpic 및 엔트로피 부분 D를 추정하고 [설명하는 것은 용이하지 않다 (133) ]. 그러나, 변성 엔탈피 ΔH D삼중 나선 구조의 정도에 민감한 매개 변수입니다. 가용성 샘플의 경우,이 정도는 또한 불용성 샘플의 열량 측정에 의해 측정되는 편광 측정으로 측정 될 수있다. 하이드 록시 프롤린 (Hyp)의 하이드 록실 그룹은 삼중 나선의 안정화 원리에 중요한 영향을 미칩니다. 종의 의존성 Hyp의 증가는 T D 및 ΔH D 의 증가와 상관 관계가있을 수 있기 때문입니다 [ 130 ]. 대부분의 조사는 그러한 물 네트워크에 관한 간접적 인 힌트만을 제공했지만 [ 133 , 141 , 142 ], Bella et al. [ 143 ]의 측정 모델 및 콜라겐 펩티드 등에 주위의 물 구조를 계산할 수있다. 물 분자가 3 중 나선 구조를 추가로 안정화시키는 것으로 추론되었지만 오늘날까지는 증명할 수 없었습니다. 콜라겐 (4)의 엔트로피 구동 조립체는 TD를 대략적 으로 증가시킨다 . 포유 동물의 피부 및 힘줄 콜라겐에 대해 약 60 ℃의 값을 달성하기 위해 20K. 추가적인 가교 결합 (6)은 열 안정성 : 성숙시 포도당-기재 가교 결합 ( 77 , 87 , 144 ) 및 합성 화학 작용제를 15K에서 60K 이상까지 더 증가시킨다. 비가 교 콜라겐 분자의 조립 및 분해는 가역적이며 ([1) ⇔ (4)] 마찬가지로 T D 의 차이는 있지만 ΔH D 는 영향을받지 않습니다. 수용성 콜라겐 (5)의 침전 무질서도 증가 T D가 아닌만큼 재 조립 (4)에 의해 정렬이 달성 될 수있다. T보다 높은 온도 적용하여 D 또는 hydrotropic 상온에서 제 (예 : 우레아의 LiBr, SCN 첨가하여 - 단일 가닥으로 단백질 용액 변성에 콜라겐 분자). 콜라겐 분자를 피 브릴로 조립하고 재 조립하는 것과 대조적으로, 가용성 콜라겐의 삼중 나선의 변성은 부분적으로 가역적이며 물리적 겔로 이어진다 [(1) ⇎ (2); (2) ⇔ (3)]. 시험관 내에서 단일 쇄로부터 콜라겐 분자의 완전한 형성은 제한된 조건 하에서 만 가능할 것으로 보인다 [ 145 , 146 , 147 , 148 , 149 ]. 젤라틴은 콜라겐의 가수 분해물이며, 이것은 토포 케미칼 가수 분해에 의해 제조되며, 이는 콜라겐 조직을 가용성으로 만들기 위해 특정 결합의 선택적 절단을 의미한다 [ 150 ]. 변성 가용성 콜라겐 젤라틴과 달리 넓은 분자량 분포를 보여줍니다. 냉각 ([2) ⇔ (3)]에 의한 젤라틴 용액의 겔화는 콜라겐 사슬의 불완전한 재 조립으로 해석됩니다. 첫째, 시험관 내에서의 이러한 불완전한 삼량 체화는 젤라틴 분자의 이러한 광범위한 분자량 분포와 원래의 콜라겐 분자의 뚜렷한 피크에서 현저하게 벗어난 공정-유도 콜라겐 펩타이드 및 응집체와의 "오염"에 기인 한 것으로 추정된다 [ 151 , 152]. 둘째, 특히 젤라틴 공정 동안 콜라겐의 화학적 구조는 Gln과 Asn의 탈염을 통해 변형된다 [ 153 ]. 또한, 젤라틴 겔의 겔화 속도는 시스 구성에서 이미 노산의 이성질체 화로의 전환에 의존하고 [ 154 ], 젤라틴 겔의 삼중 나선 함량은 수개월에 걸쳐 증가하고있다 [ 152 ]. 따라서, 젤라틴 겔의 용융 온도는 T보다 항상 낮은 D 대응 콜라겐 분자의 (3). T 건조시 D의 증가 및 ΔH D는 감소한다. T에 대한 엔트로피 적 기여 있음이 보여 D는 수소 결합의 수는 15 ~ 중량 %보다 낮은 수분 제거함으로써 감소되는 동안, 더욱 더 중요하게된다 (도. 9 ). 물이 거의없는 콜라겐 방송 T D 220 ° C까지의 변성 엔탈피는 1/5 완전히 수화 콜라겐의 값의 최소값까지 감소있다. 이것은 삼중 나선의 중심에있는 수소 결합의 엔탈피 부분과 일치한다. 증가하는 엔트로피 부분은 콜라겐 분자의 이동성 감소와 관련이있다. 그것은 콜라겐의 탈수 증가에 따라 점점 더 우세하다 [ 142 , 155, 156 ]. 변성 온도와 엔탈피는 조직도 및 콜라겐의 탄생에 대한 중요한 힌트를 제공합니다. 공정을 제어하고 변성을 방지 할 수 있습니다. 그림 9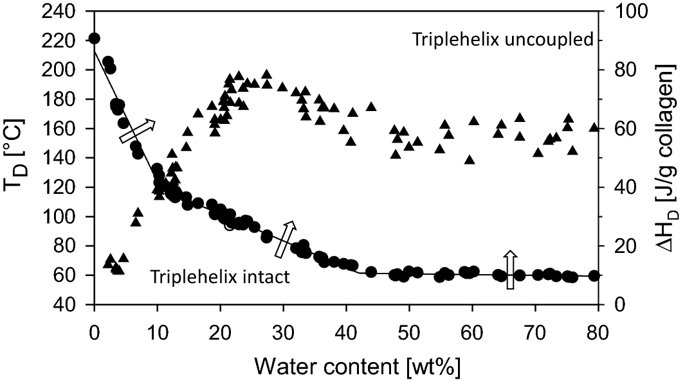 변성 온도 T D (채워진 동그라미) 및 변성 엔탈피 ΔH D 상이한 수분 함량에서 탈세 포화 된 소 피부 (채워진 삼각형). T 경우 D는 초과 (화살표) 콜라겐 트리플 헬릭스 커플 해제. 건조 조건에서 T D는 증가하고 ΔH D는 감소합니다 [ 156 ] 확산 및 흡착피부, 힘줄, 심낭 또는 소장과 같은 collagenous 조직이 non-collagenous 물질로부터 정제 될 때 화학 첨가물의 확산과 흡착 및 반응 속도론을 집중적으로 고려해야합니다. 상이한 조직 구조는 분자 확산에 대한 거대한 장애물이다. (2) 조직 구조는 분자량에 해당하는 유체 역학적 부피에 관해 분자를 분리한다. (3) 임의의 단백질로서 다른 많은 천연 중합체와 달리, 콜라겐은 음이온, 양성자, 친수성 및 소수성 물질을 포함한 양이온의 교환 체로서 작용하며, (4) 콜라겐의 교환은 pH 및 온도에 의존한다. 특히 피부와 내장을 통한 확산은 가공에 중요 할뿐만 아니라 화장품과 제약 산업에도 중요한 매개 변수입니다. 시험 관내 및 생체 내에서 예를 들어 피부 또는 장을 통한 물질의 투과성을 설명하기 위해, 많은 상이한 모델이 개발되었다. 이들은 소수성 세포층을 통한 다른 침투 메커니즘을 가정하는 화학적 특성 (소수성, 분자량) 또는 기계적 모델 (벽돌 및 모르타르 모델)을 참조하는 부분적으로 수학적 모델입니다. 현재, 공개 된 모델은 물질의 혼합물, 예를 들어 계면 활성제로 유화 된 소수성 첨가제, 또는 상이한 소수성 물질의 조합 및 적용 동안 이들의 부분 계수를 무시한다 [ 157 , 158 ,159 , 160 , 161 , 162 , 163 , 164 , 165 ]. 피부의 경우, 이들 모델은 주로 죽은 각질 세포 및 각질로 구성되는 각질층이 가장 강한 장벽으로 가정합니다. 장 모델은 점막과 활성 막 수송을 고려합니다. 생체 물질을 제조하기 위해 조직을 가공 할 때, 비 콜라겐 부분은 가능한 한 완전히 제거됩니다. 종종 콜라겐 원료는 배플이 내장 된 움직이는 드럼 또는 교반 된 반응 용기에서 과도한 수성 부유물로 처리됩니다. 기계적 스트레스를 피하기 위해 collagenous 조직도 배치 용기에 고정되어 있거나 정제 액은 원형으로 만 펌핑됩니다. 처리는 5 ~ 30 ° C의 온도에서 몇 시간에서 며칠 동안 지속됩니다. 이러한 교반 시스템에서 플로트는 화학 물질을 첨가 한 후 몇 분 후에 이상적으로 혼합 된 것으로 가정 할 수 있습니다. 그러므로, 첫 번째 접근법은 강제 교반 때문에 조직 구조를 통한 확산과 대조적으로 플로트에서의 확산을 논의 할 필요가 없다 [ 20 , 166 ]. 콜라겐 구조는 다른 분자량에 대한 컷오프를 보여줍니다. 확산 실 시스템에서 자신 미발표 결과 (기재의 콜라겐 막에 의해 분리 된 두 교반 챔버 [ 167 ]) 보여 주었다 (도. 10 a) 그 염화나트륨 확산되어 매우 빠른 상업용 돼지 진피 계 멤브레인을 통한 (Biogide ® ) 히알루 론산 (분자량 M w ~ 1.2 MDa)은 광범위하게 배제된다. 콜라겐 스폰지 및 콜라겐 실과 같은보다 복잡한 확산 장벽의 컷오프를 조사하기 위해 유사한 모델을 사용하여이 관찰을 확인했다 [ 168 ]. Ho et al. [ 169]는 가교 된 가용성 콜라겐 필름을 사용하였고, 가교도는 확산 거동에 영향을주는 것으로 밝혀졌다. 그림 10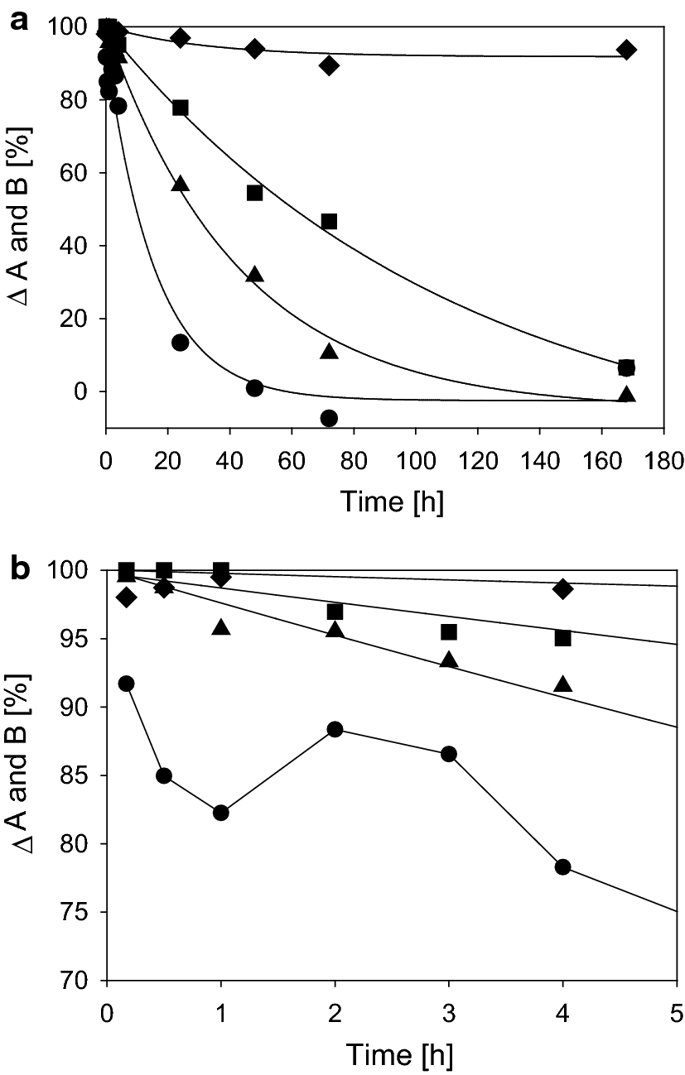 , B 콜라겐 막 (Biogide 통해 다른 물질의 투과성 ® 돼지 피부에서 제조). 챔버 A와 B 사이의 확산 속도는 물질 ( a ) 의 분자량 및 화학적 성질에 의존 한다. 염화나트륨은 포화 될 때까지 저농도로 흡수된다 ( b ). 채워진 삼각형 : 트립토판; 채워진 원 : NaCl; 채워진 사각형 : 포도당; 충전 된 다이아몬드 : 히알루 론산 (M w ~ 1.2 MDa); (미공개 데이터 소유) 적은 양의 투과 분자의 경우 콜라겐은 교환기처럼 행동합니다. 다수의 하이드 록실 그룹을 갖는 글루코스 (M w 180 g / mol) 는 소수성 아미노산이지만 글루코스와 분자량이 유사한 트립토판 (M w 204 g / mol) 보다 조사 된 Biogide ® 막을 통해 느리게 확산 되었다. 흡착 염화나트륨 (도. 같은 이온이 관찰되었다 (10) b), 다른 저자들은 칼슘 이온 [대한 흡착을 관찰 166 , 170 ], 계면 활성제 [ 167 , 171 , 172 ], 성장 인자 [ 173 , 174 , 175 , 176], 또한 내 독소 [ 177 , 178 , 179 , 180 ]. 저농도의 흡착 된 분자는 많은 양의 세척 부유물과 원치 않는 흡착 물을 대체 (이온, 양성자) 또는 결합 (킬레이트 제) 할 수있는 과량의 분자로만 제거 할 수 있습니다. 원료의 구조는 일반적으로 균질하지 않습니다. 예를 들어 피부는 확산이 관련 매개 변수가 될 정도로 비대칭적이고 두껍습니다. 비대칭은 가공 제가 양면으로부터 피부로 확산 될 때 고려되어야하는 양쪽으로부터 상이한 확산 계수를 초래한다. 장 점막하 또는 심낭과 같은 얇은 콜라겐 물질을 치료할 때, 확산은 작은 역할을합니다. 대조적으로, 큰 힘줄 (예를 들어 말, 소 또는 돼지 소스에서 온 힘줄 균)은 충분한 확산을 달성하기 위해 오랫동안 처리해야합니다. 혈관의 층류가 가정되어야하기 때문에 장기 탈세 포화는 특히 어려운 과제이다. 확산은 용기의 막을 가로 지르는 생체 내 상황과 유사하게 발생하며, 모든 비 구조 물질을 제거하기 위해서는 큰 세척 량이 필요하다. 선박 트리의 복잡한 구조와 예측할 수없는 유체 역학적 동작으로 인해 확산 시나리오를 예측하거나 모델링하기가 매우 어렵습니다. 그러나 청소 절차를 최적화하려면 이것이 매우 중요합니다. 반응 속도론반응 동역학을 조사하고 변성 및 섬유 조립과 같은 콜라겐의 구조적 변형뿐만 아니라 콜라겐과 젤라틴 (가변 콜라겐)의 가교 및 변형과 같은 많은 다른 화학 반응에 대해서도 조사하고 계산 하였다. 상이한 동역학은 온도뿐만 아니라 pH 및 염 또는 유기 성분과 같은 첨가제 및 용매의 종류 및 양에 의존한다. 적어도, 다른 동역학 사이에는 상호 작용이 있습니다. 표 5 는 상이한 반응 및 구조적 전이의 반응 속도를 비교한다. 표 5 조직 탈세 포화, 정제 및 처리 동안 처리 시간에 영향을 미치는 다른 동역학을 고려해야합니다풀 사이즈 테이블 용액에서 콜라겐 삼중 나선 (나선 ↔ 코일)의 변성 과정은 수십 년에 걸쳐 논란이되어왔다. 마일 [ 181 ]은 돌이킬 수없는 속도 프로세스를 가정 한 반면, 열량 측정 결과는 모노머와 트리머의 평형으로 해석되었습니다 [ 58 , 134 , 136 , 148 ]. 변성은 콜라겐 분자가 분리 된 경우 (pH ≠ IEP) 초 단위로만 지속되는 빠른 과정입니다. 삼중 나선의 완전한 재생은 이상적인 시스템 (콜라겐 타입 III, 이황화 결합, 희석 된 용액, 긴 반응 속도에 의해 한 위치에서 가교 됨)에서 가능합니다. 시스-트랜스 전이, 구조적 특징 및 부분적 절단에 의해 방해된다 [ 134 , 148 ]. 재생 동역학은 시스-트랜스 전이에 의해 결정되며 느린 프로세스입니다. 젤라틴은 매우 광범위한 분자량 분포를 갖는 변성 된, 부분적으로 절단 된 콜라겐이며, 이는 종종 제조 공정으로부터 생성 된 가교 된 특정 성분을 여전히 함유한다. 따라서 콜라겐 삼중 나선의 재생에 해당하는 설정 속도는 이상적인 콜라겐의 설정 속도보다 훨씬 느립니다. 젤라틴 용액을 냉각시킴으로써 세팅이 매우 빠르게 시작되지만, 실제로 측정 가능한 시간으로 끝나지는 않는다 [ 152 , 182 , 183 , 184 ]. 체외 콜라겐은 온도, pH 및 첨가제에 따라 다양한 길이와 두께의 미세 섬유와 섬유로 조립된다 [ 185 , 186 ]. 피 브릴 화는 식염수 포스페이트 완충액 (PBS)에서 pH 9.2의 분 범위에서 가장 높은 피 브릴 화율을 갖는 등전 범위에서만 발생한다 [ 187 ]. 조립 속도뿐만 아니라 섬유 길이와 두께의 분포는 추가 첨가제 (예 : 글리신)와 온도에 따라 달라집니다 [ 188 ]. 섬유가 낮은 온도에 노출되면 재 조립 된 콜라겐의 분해가 일어난다. 냉각 속도가 높을수록 분해 속도가 빠릅니다. 그러나 일부 작은 필라멘트가 남아 있습니다. 이러한 안정적인 응집체의 이유로 가교를 가정 한 초기 조사와 달리 [ 189 , 190 ], de Wild et al. [ 191 ]은 안정한 응집체가 다시 산에 완전히 용해 될 수 있기 때문에 동 역학적으로 안정화된다고 가정했다. 마지막으로, 콜라겐 및 젤라틴은 측쇄, 특히 아민 (Lys) 및 카르 복실 산기 (Glu, Asp)의 거의 모든 가능한 반응을 포함하는 다목적 화학 반응에 의해 광범위하게 변형되고 안정화된다. 가능한 반응물의 예는하기에 언급되어있다 (단면 가교). 반응 시간 및 조건은 반응만큼 다양하고 포괄적 인 고려 사항은 본 검토의 초점을 벗어난다. 실제적인 관점에서, 반응 시간은 일반적으로 몇 시간 이상 지속되지 않는 제조 공정에 맞춰져야한다. 그러나 확산과 평형이 여전히 가능하려면 반응 시간이 너무 빠르지 않아야합니다. 예를 들어, 알돌 또는 축합 형 타닌은 종종 몇 시간에서 며칠까지 반응 속도를 보이는 반면 알데히드는 몇 초 이내에 반응 할 수 있습니다 [ 192, 193 , 194 , 195 , 196 ]. 복잡한 구조를 포함하는 콜라겐 조직에서 화학 반응은 항상 조직 내 화학 물질의 확산과 경쟁합니다. 따라서 어떤 프로세스가 선호되는지에 대한 쉬운 규칙, 즉 확산 또는 화학 반응이 없습니다. 이러한 하위 프로세스의 결합 해제는 pH를 조정하여 가장 쉽게 달성 할 수 있습니다. 가능한 반응성 그룹 (예 : –NH 2 )은 화학 물질의 확산이 평형을 달성 할 때까지 산성 pH에서 비 반응성 (-NH 3 + ) 으로 만 사용할 수 있습니다 . 아미노산의 알칼리성 pH 및 카르 복실 산 측쇄에도 동일하게 적용된다. pH를 신중하게 조정함으로써 반응을 조절할 수있다. 분자량 분포 및 입자 크기프로 펩타이드가없는 인간 타입 I 콜라겐 사슬의 분자량 (UniProt, P02452, P08123; Expasy ProtParam)은 94.8 kDa (α1 (I)) 및 93.6 kDa (α2 (I))로 계산됩니다. 콜라겐 분자의 계산 된 분자량은 283 kDa 일 것이다. 콜라겐 사슬 타입 I의 분자량을 SEC-MALS로 측정 한 결과, 약 300 kDa의 변성 된 삼중 나선의 92 kDa 인 것으로 밝혀졌다. α1 (I) 및 α2 (I) 사슬의 크로마토 그래피 분리는 불가능했습니다 [ 151 ]. SDS-PAGE와 같은 다른 단백질 화학 방법은 다른 콜라겐 사슬과 특정 펩티드를 분리 할 수있게한다 [ 197 , 198 , 199]. 조직에서 콜라겐은 공유 결합에 의해 세포 내 및 3 면간으로 가교된다. 가교 결합의 수는 연령 [ 77 ]에 따라 증가 한다. 이는 더 이상 측정 할 수없는 매우 높은 분자량을 초래합니다. 표 6 은 다르게 처리 된 물질의 분자량을 보여준다. Permacol ® 및 Xenoderm ® 은 결합 조직 구조가 저장된 탈세 포화 된 조직입니다. 반대로 Surgicoll ® 및 Resodont ® 는 정제 된 습식 지상 조직으로 제조됩니다. 표 6 다양한 조건에서 다양한 상업적 형태의 콜라겐 물질과 그 특성 용해도, 추정 분자량 및 분포, 나선형 정도 및 추정 된 가교 함량풀 사이즈 테이블 습식 분쇄는 식품 산업을위한 콜라겐 현탁액을 제조하고 의료 응용을위한 콜라겐 스폰지 및 막을 제조하는 확립 된 기술이다. 입자의 형상, 입자 자체의 집중적 인 상호 작용 및 입자와 일반적으로 수성 분산 매질 사이의 낮은 콘트라스트로 인해 습식 콜라겐의 입자 크기를 결정하는 것은 매우 어렵다. 팽윤 된 상태에서의 미세한 외관은 섬유질, 로브 형, 부분적으로 겔 형인 것으로 밝혀졌고, 따라서 크기 나 형태가 균일하지 않았다. 분쇄 정도와의 일부 상관 관계는 초 원심 분리, 현미경 또는 입자 계수에 의해 발견됩니다. 크로마토 그래피 절차 또는 입자 크기 측정과 달리 반복적 인 정확도는 달성하기 어렵습니다. 물리적 얽힘과 물리 화학적 상호 작용을 완전히 배제 할 수 없기 때문입니다. 측정 순간은 pH, 이온 및 수분 함량에 의해 다시 현저하게 변화되는 단일 관찰만을 반영합니다. 따라서 산업 공정에서, 특히 점도는 가공성을 평가하기 위해 측정됩니다.200 , 201 , 202 ]. 콜라겐 조직이 건조한 상태에서 분쇄되면, 가장 작은 입자 크기는 100 미크론 이상이다. 입자는 섬유 단편으로 나타난다 [ 203 , 204 ]. 부분 변성 된 조직은 열가소성 기계 (열가소성 콜라겐)에 의해 처리 될 수있는 훨씬 더 작은 구형 입자로 분쇄 될 수있다 [ 205 ]. 분자 분산 콜라겐 제제의 매우 광범위한 분자량 분포는 예를 들어 젤라틴 제조 동안 조직의 열적 및 화학적 분해 결합에 의해 발생한다. Mw > 10 7 ~ <10 3 Da의 특정 구성품부터 다양 합니다. 조직이 어떻게 처리되는지에 따라, 별개의 피크 (젤라틴 타입 B) 또는 넓은 피 크리스 분포 (젤라틴 타입 A)가 관찰됩니다 [ 151 , 152 , 206 , 207 ]. 콜라겐 처리 – 툴박스콜라겐 물질의 가공은 몇 시간에서 며칠까지 지속되는 일련의 기술 단계로 구성됩니다. 이러한 단계 중 많은 부분은 수동 처리가 필요하며 자동화 수준이 낮은 경우가 많습니다. 기술적 단계는 기계적, 화학적 및 물리적 처리를 포함한다 [ 3 , 4 , 20 , 21 , 208 , 209 ]. 그림 11는 시퀀스, 적용된 화학 작용제 또는 물리 처리의 변형과 같은 기술 단계의 주요 조합과 중요한 매개 변수 용해도, 습윤 상태에서의 물리적 안정성, DNA 함량 및 미생물 품질 (CFU-콜로니 형성 단위)에 미치는 영향을 제시합니다. 콜라겐 기반 생체 재료를 제조하려면 조직을 정제 (붕해, 재 형성, 안정화, 건조), 포장 및 멸균해야합니다. 괄호 안의 단계는 선택 사항입니다. 콜라겐 구조에 대한 몇 가지 화학 작용제의 효과는 다음 장에서 자세히 설명합니다. 그림 11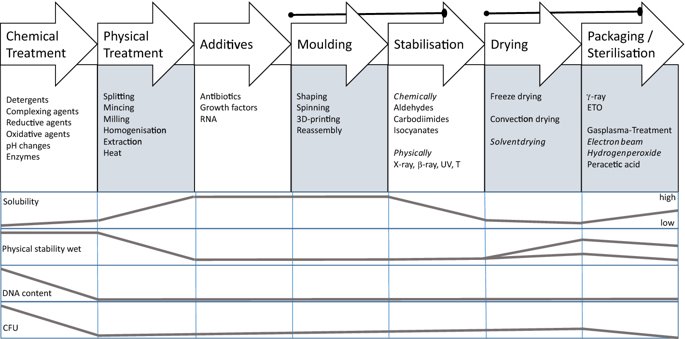 콜라겐 처리 기술, 처리 단계 및 파라미터 용해도, 물리적 안정성, DNA 함량 및 콜로니 형성 단위 (CFU)에 미치는 영향의 최신 기술. 브래킷은 일반적으로이 순서로 결합되는 프로세스 단계를 연결합니다 단계의 순서는 반드시 고정 될 필요는 없지만 종종 도시 된 바와 같이 사용됩니다. 안정화 (가교 결합)는 생체 내 분해를 조절하는데 사용될뿐만 아니라 일반적으로 새로운 형태를 고정시키기 위해 성형 을 따른다 . 멸균 및 저축 제품을 판매하기위한 마지막 단계로서 패키징 이 대기된다 [ 210 ]. 때로는 초기 단계에서, 특히 습식 제품이 생산 될 때 멸균이 수행되어 무균 다운 스트림 처리 및 포장이 발생합니다 [ 210 ]. 언급 된 일련의 기술 단계의 상이한 변형의 적용에 의해, 이러한 상이한 물질은 예를 들어 진피, 심낭, 소장 또는 요로에서 탈세 포화 된 막, 주 사용 용액, 주사 가능한 현탁액, 힘줄 및 다진 피부로부터의 막, 분말 및 스폰지 및 최종적으로 가수 분해되고 변성 된 콜라겐 [ 1 , 3 , 7 , 27 , 208 , 209 , 211 ]. 그림 12 는 콜라겐 유래 물질의 분야를 두 가지 주요 처리 방향으로 구분합니다. 한 방향은 기계 화학적 공정으로 구성되며, 두 번째 방향은 열 변성을 나타냅니다. 두 방향 모두 근본적으로 다른 재료로 이어집니다. 조직으로부터의 물리-화학적 추출은 삼중 나선 구조 (산 가용성 콜라겐) 및 화학적 (데 사미도 콜라겐)을 저장하고 효소 처리 (아틀로 콜라겐)는 변형 된 삼중 나선 콜라겐 분자를 포함한다. 그림 12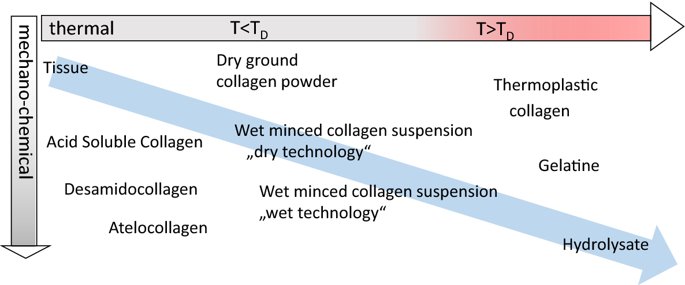 다른 기술로 제조 된 콜라겐 재료. 파란색 화살표 마크 콜라겐 구조 desintegration 정도 적색 범위 T보다 높은 재료의 열처리 D 조직의 용해도는 화학 처리에 의해 약간 증가하지만 물리적 분해에 의해 현저하게 증가합니다. 역으로 물리적 안정성은 기계적 분해에 의해 감소합니다. 메움 형 콜라겐 분말 (건식 분쇄) 또는 현탁액 (습식 다진)은 기계적 분해에 의해 달성됩니다. 이들 기계적 붕해 단계 이전에 조직은 가능한 한 많이 정제되어야한다는 것을 언급 할 필요가있다. 그러나 콜라겐의 구조에 영향을 미치는 오래 지속되는 화학 처리, 특히 열 처리는 방지됩니다. 분말은 건조에 의해 붕괴 된 콜라겐 섬유 및 섬유 다발을 반영한다. 불순물이 완전히 캡슐화되어 제거가 불가능합니다. 젖은 상태에서 다진 콜라겐은 매우 점성이 있습니다. 더욱이, 열처리는 3 중 나선을 분리합니다. 열처리 전에 원료를 가능한 한 많이 정제 할 필요가있다. 열가소성 콜라겐은 화학 물질로 짧은 처리 만하고 삼중 나선의 열 결합을 유지하는 중간체를 기술하지만 [ 205 ], 젤라틴과 가수 분해물은 화학적, 기계적 및 열처리에 의해 집중적으로 처리된다. 후자는 여과 및 크로마토 그래피 방법과 같은 많은 다른 기술에 의해 용이하게 정제 될 수있는 가용성 생성물이다 [ 212 , 213 ]. 분자량 이외에, 표 6 은 다르게 처리 된 물질의 다른 특성을 보여준다. 열가소성 콜라겐을 제외한 모든 재료는 시판 제품도 반영합니다. 용해도가 분해도에 따라 증가하고 분자량이 감소한다는 것이 명백하다. 가교는 용해도를 방지하고 가교 된 샘플은 종종 매우 높은 분자량을 나타낸다. 삼중 나선 콘텐츠 직접 T 초과하는 열처리 상관 D를 . 그림 13 -f는 처리 순서의 변형에 의해 제조 된 다양한 재료의 주사 전자 현미경 외관을 비교한다 [ 209 ]. 탈세 포화 심막 (도. 동결 건조 (13) a) 및 탈모 탈세 포화 된 피부 (도. 13 d)는 원 조직의 대응 구조를 반영한다. 심낭 섬유소가 어느 정도 박리되는 동안, 피부에서 콜라겐 섬유는 응집체를 묶는다. 장선 (도. 13 (F))을 장력하에 건조 작은 가닥 절단 트위스트 대류가 SIS 정제로 제조된다. 중간체를 제조하는 일반적인 기술은 가죽을 탈세 포화 한 후 습윤 상태에서 균질화 및 건조하는 것이다. 다공성 스폰지 (그림 13b) 동결 건조, 및 소형 막 (도.에 의해 달성된다 (13) 대류 건조 d). 또한 젤라틴은 변성 콜라겐을 반영하는 일련의 현미경 사진에서 유일한 재료입니다 (그림 13c ). 그러나, 삼중 나선이 여전히 존재하는 필름과 젤라틴 간에는 현미경 적으로 차이가 관찰되지 않았다. 그림 13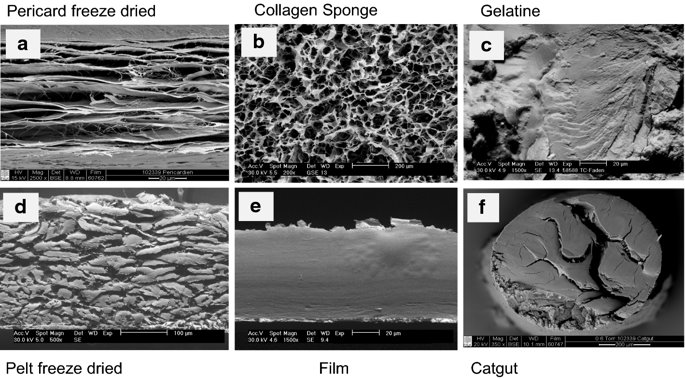 주로 다른 가공 재료의 미세한 구조 비교 심낭 ( a ) 및 피부 ( d )는 탈세 포화되고 동결 건조되며, 스폰지 ( b )는 정제 된 피부가 다진 후 동결 건조되고 , 대신 대류 건조 된 필름 ( e )이 건조된다 . Catgut ( f )는 정제 소장 (SIS)으로 구성되어 있으며, 가닥으로 자르고, 꼬이고, 가교시켜 안정화시키고, 대류 건조시킵니다. 젤라틴 ( c )은 대류 건조 된 피부 또는 뼈의 가수 분해 콜라겐 단계 화학 처리 (도 11 )는 일반적으로 전체 프로세스의 속도 제한 단계이다. 처리 시간은 확산 및 반응 시간과 직접적으로 관련된 작용제의 농도 및 농도 구배, 처리 온도 및 세척 강도에 따라 달라집니다. 처리 시간은 조직, 구조 및 처리량에 따라 상당히 다릅니다. 피부와 힘줄은 두껍고 콤팩트하지만 심낭은 훨씬 얇지 만 컴팩트하며 소장은 얇고 탄력적입니다. 표 7 은 다른 재료에 대해 선택된 공개 처리 시간을 비교합니다. 더 많은 프로세스가 특허에 적용되었습니다 [ 210] 현실적인 가치를 찾기가 쉽지 않습니다. 게시 된 시간은 동일한 조직에 대해서도 광범위하게 다양하며 사양 및 한계와 직접적으로 관련되지 않은 최적화 가능성이 심각한 것 같습니다. 예 — 물리적, 열적 및 효소 적 안정성을 변화시키는 선택된 기술결합 조직을 처리하면 기계적, 물리적 및 화학적 수단에 의해 구조가 다른 정도로 저하됩니다. 생성 된 물질은 파괴 정도만 다르고 분해 메카니즘에 따라 동일한 원료 콜라겐에 기초하여 가용성 콜라겐 가수 분해물까지 안정한 조직을 포함한다 (도 12 ). 가능한 모든 콜라겐 물질의 범위를 커버하기 위해, 온도에 대한 안정성 및 효소 분해와 근본적으로 다른 다양한 기술 및 결과 물질의 5 가지 예가 이후에 논의 될 것이다. 저장된 조직 구조-탈장 임플란트탈세 포화는 일반적으로 성장한 조직의 기계적 구조를 저장하는 것을 목표로합니다. 기계적 성질은 가능한 한 적게 영향을 받아야한다. 또한 엘라스틴을 제외한 모든 비 콜라 게 노스 물질을 제거하는 것이 목표입니다. 이것은 예를 들어 구형 단백질, 결합 포도당 및 갈락토스 분자, 지질, DNA, 세포막 성분, 핵 및 필요한 경우 가공 제에 관한 것이다. 어느 정도까지는 성장 인자가 저장되거나 제거 될 수 있습니다. 그럼에도 불구하고, 1 회 또는 반복 된 동결-해동 사이클 후, 탈세 포화는 착화 제, 계면 활성제, 또한 알칼리 및 산 및 가능한 효소에 의한 집중적 인 처리를 포함한다 [ 3 , 4 , 20 , 21]. 피부 결합 조직, 심장 막, 소장 및 밴드 구조를 저장하여 인간, 돼지, 소 및 말 소스에서 제조 한 (Epiflex ® , Xenoderm ® , Xenoguard ® 오아시스 ® ). 시판되는 재료의 예는 표 1에 나열되어 있습니다. 상기 효소 분해에 이들의 탈세 포화 된 조직을 안정화하기 위해, 그들이 화학적 수단에 의해 가교 결합 될 수있다 (Permacol ® , CuffPatch ™ 두라 가드 ® ). 탈세 포화 전략은 전체 장기의 복잡한 구조가 충분히 정제 될 수 있고, 오염 물질이없는 경우 장기 대체를 위해 재세 포화 될 수 있다는 희망을주었습니다. 그러나, 현재 탈세 포화의 품질 및 그 평가가 승인되어야하고, 재세 포화는 여전히 중요한 도전이다 [ 214 , 215 , 216 , 217 , 218 ]. 저장된 섬유 다발, 섬유 및 삼중 나선-지혈 스폰지 및 치과 용 필름조직을 탈세 포화하는 기술은 섬유질 제제로 추가로 분해되는 원료를 정제하는 데에도 사용됩니다. 후속 주요 단계는 조직의 집중적 산성화 후 추위에서 분쇄 및 다진이다. 기계적 분해 단계는 겔 형태의 콜라겐 섬유가 매우 부어있는 현탁액으로 이어집니다. 그러나 트리플 나선은 대부분 그대로 남아 있습니다. 피부 또는 힘줄이 95 % 이상의 콜라겐, 적은 양의 지방 및 일부 비 콜라 게 노스 단백질 (특히 엘라스틴)로 구성되는 원료로 사용되는 경우, 여전히 시스템의 일부입니다. 피부를 원료로 사용하는 경우, 이러한 기술은 종종 pH 1에서 pH 13까지의 pH 범위를 포괄하는 강산 및 알칼리를 이용한 매우 집중적 인 처리로 구성됩니다 [ 219]. 이어서 정제 동안 글루코 사 미노 글리 칸 및 핵산이 완전히 제거된다. 이 부풀어 오른 젤에서 오염 물질을 제거하는 것은 거의 불가능합니다. 압출 성 물질은 5 ~ 10 %의 건조 물질 함량에서 매우 높은 점도를 나타내며 약제 및 심지어 양성자의 확산 률이 낮습니다. pH 조정은 몇 시간 지속되며, 혼합 및 균질화에는 높은 기계적 에너지가 필요합니다. 화학 물질의 실제 균질 분포는 며칠이 필요합니다. 주조 가능한 현탁액은 1 % 이하의 희석에서만 달성된다. 이러한 현탁액을 분자 수준에서 여과하는 것은 불가능하며, 따라서 기계적 균질화 전에 가능한 많은 수반되는 물질을 제거하는 것이 편리하다. 점도를 변화시킴으로써, 현탁액을 다양한 치수의 튜브, 실, 필름 또는 스폰지 형 성형품으로 용이하게 성형 할 수있다 [ 4 , 200 ,예를 들어 , 220 , 221 , 222 ], 예를 들어, 원료 물질의 치수와 상관되는 제한된 치수의 탈세 포화 된 조직을위한 허점. 섬유질 현탁액의 재구성에 기초한 시판되는 재료는 MBcollagen ® , Matristypt ® 또는 Parasorb ® 가 그 예입니다. 재 조립 된 가용성 콜라겐의 주사제 및 고형 물품가용성 콜라겐은 기재된 바와 같이 유기산에 의해 추출되고 여과되어 멸균 성을 달성한다. 이러한 용액은 산 용해성 콜라겐을 차가운 상태로 완충시키고 체온으로 온도를 상승시켜 겔을 형성하도록 재 조립된다 [ 223 ]. 이 원리는 시험관 내에서뿐만 아니라 현장에서 연조직 확대 술 (Zyderm ® ) 에 주사하기 위해 오랫동안 사용되어왔다 . 저온 완충 가용성 콜라겐을 주사하고 체온으로 개시 한 현장에서 재 조립 하였다 [ 3 ]. 재 조립 된 콜라겐은 온도, 첨가제, 완충 농도 및 콜라겐 공급원 및 제조물에 따라 전형적인 크로스 줄무늬 및 섬유 크기를 보여줍니다. 수용성 콜라겐은 세포 배양 웰 플레이트의 표면을 코팅하고 필름을 제조하는데 사용될 수 있으며, 다층 시트, 튜브형 구조 및 캡슐과 같은보다 복잡한 물질을 제조하는데 사용되었다 [ 224 ]. 경질 조직 대체 물질은 예비 중합 실록산의 재 조립 및 규화에 의해 또는 재 조립 된 겔과 하이드 록시 아파타이트의 조합에 의해 제조되었다 [ 225 , 226 , 227 , 228 ]. 또한, 가용성 콜라겐은 다양한 기술로 회전 할 수 있습니다 (아래 참조). 가용성 콜라겐의 단점은 고체 물품을 제조 할 때 그램 당 가격이 비교적 높다는 것입니다. 열처리, 불용성 콜라겐섬유질 콜라겐은 구형 입자를 갖는 분말로 옮길 수없고 솜처럼 된 물질로만 옮길 수 있습니다. 그러나, 콜라겐이 부분적으로 변성되면, 섬유질 구조가 붕괴되어 합성 중합체와 유사한 열가소성 기계에서 콜라겐을 가공 할 수있다. 이 열가소성 콜라겐 (TC)을 준비하기 위해 피부가 탈모되고 탈세 포화됩니다. 콜라겐 삼중 나선은 변성되어야하며, 이는 과도한 온수 (80 ° C)에서의 처리, 마이크로파에서 습식 재료 (115 °)의 압출 또는 고온 증기의 건조 오븐에서의 처리에 의해 달성 될 수있다. 이어서 재료를 건조시키고 분말로 분쇄한다. 이 분말은 물, 글리세롤 및 기타 첨가제를 첨가하여 압출을 위해 준비된다 [ 205 , 229 ]. 부분 변성 때문에 TC는 젤라틴의 일부 특성을 보여줍니다. 물에 담그면 건조 된 물질이 젤처럼됩니다. 팽윤에 의해 수백 퍼센트의 물을 차지하며, 프로테아제에 의해 쉽게 분해 될 수있다. 젤라틴과 달리 따뜻한 물에는 거의 녹지 않습니다 [ 205 , 230 , 231 , 232 ]. 15 ~ 20 %의 물이 존재하는 경우, 필름, 실, 튜브로 압출하거나 3D 제품으로 사출 성형하여 재료를 가공 할 수 있으며, 이는 다른 단백질과 비교하여 독창적 인 것으로 보입니다 [ 229 ]. 열가소성 가공에 의해 충전제로서뿐만 아니라 제 2 중합체 성분으로서 작용하는 합성 중합체와 광범위하게 혼합 될 수있다. 또한, TC를 히드 록시 아파타이트와 혼합하여 열가소성 공정에 의해 뼈 유사 물질을 생성시켰다. 그 결과 건조하고 가공 가능한 부품은 뼈와 같은 기계적 성질을 나타 냈습니다. 식염수 완충 용액에 노출시킴으로써, 콜라겐은 다시 겔형이되었다. 열가소성 콜라겐으로 만들어진 물질은 아직 동물 및 임상 시험에서 테스트되지 않았습니다. 젤라틴의 의료 응용젤라틴은 의료 및 관련 응용 분야에서도 몇 가지 전통을 가지고 있습니다. 캡슐과 미세 구를 생성하고, 세포 배양 플레이트의 표면을 코팅하고, 섬유 기반 혈관 임플란트를 코팅하고, 지혈 스폰지, 안과 용 필름을 제조하고, 최종적으로 혈장 대체물 및 접착제를 만드는 데 제약 보조제로 사용됩니다 [ 6 , 233 , 234 , 235 , 236 , 237 ]. 젤라틴의 겔화 능력과 20 ° C ~ 25 ° C의 용융 온도가 가장 중요한 특성 인 식품 산업과 달리 [ 150], 의료 응용 분야에서 높은 생체 적합성이 주요 장점입니다. 또한, 젤라틴은 알데히드 반응, 예를 들어 환원성 당 및 식물-유래 의약품에 대한 내 화학성을 조절하기 위해 숙 신화 변형 될 수있다. 젤라틴은 많은 화학 작용제와 트랜스 글 루타 미나 제에 의해 가교되며, 효소 적 분해성은 추가적인 안정화에 의해 변형됩니다. 결합 조직에서 젤라틴까지 준비된 재료 분야에서 후자는 안정성이 가장 낮고 추가 분해에 대한 안정성이 가장 낮은 구조입니다 (그림 12 ). 혼합 특성, 예를 들어 효소 분해에 대한보다 높은 안정성 및 또한 지혈 특성을 갖는 물질을 달성하기 위해, 젤라틴은 섬유질 콜라겐 제제와 결합 될 수있다 [ 221 ]. 젤라틴 겔 콜라겐 조합 T의 온도차 이용하여 제조 할 수있는 D , 통상 30보다 낮은 젤라틴의 설정 온도를 ° C. 젤라틴이 경화되면 두 가지 용융 온도를 측정 할 수 있습니다. 하나 젤라틴 겔, 다른 T 용융 반영 D 콜라겐 [ 238 ]. 기계적 안정성에 영향을 미치는 공정 단계임상 적용을위한 생체 재료는 다루기 쉬워야하고, 외과 기술에 의해 적용될 수 있어야하고, 분해성 및 조직 통합은 주변 조직의 재생을 따라야한다. 주요 특성은 기계적 안정성 및 효소 분해성이며, 이는 기계적 분해, 3 중 나선의 변성 및 가교에 의해 크게 영향을받습니다. 예시적인 처리와 함께 하이드의 기계적 성질이도 14a , b 에서 비교된다 . 상이한 처리 단계와 관련하여 하이드 샘플을 제조 하였다. 피부는 약 16 MPa의 파단시 장력을 나타내며, 기계적 성질은 화학 정제 공정에 의해 단지 약간 영향을 받았다. 탈모 를 16 시간 동안 집중 알칼리성 (pH 12.8) 및 환원 처리 (3 % Na 2 S)로 수행하고 중화시켰다. Damink et al.에 의해 유사한 결과가 발견되었다. 양 피부용 [ 239 ]. 편리한 두께로 분할 돼지 스킨, 탈장 수리 또는 일시적으로 피부 교체 예 Strattice으로 사용됩니다 ® , XenMatrix ® 또는 Xenoderm ® [ 240 ,241 , 242 ]. 그림 14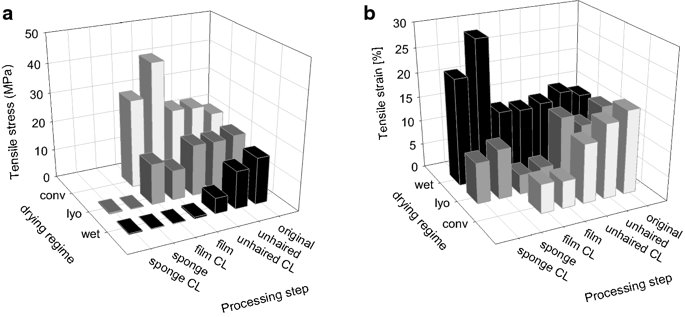 a , b 돼지 피부의 인장 응력과 변형은 건조 방식과 물리적 처리에 따라 달라집니다 (습식 : 건조 없음; 리오 : 동결 건조; 컨벡션 건조). 두 수치 사이 에서 건조 체제 축의 역 방향을 고려하십시오 [ 209 ] 마이닝은 파이버 네트워크를 손상시킵니다. 비발 한 가죽 조직이 현탁액으로 붕해되고, 필름으로 대류 건조되고 측정을 위해 재 습윤 될 때, 안정성은 습윤 상태에서 약 90 % 감소하여 조직과 비교하여 파단시 장력으로 측정된다. 이러한 방식으로 제조 된 필름은 예를 들어 탈장 복구, 임시 피부 교체 또는 치과 용 (예 : Resodont ® 또는 Biomend ® )에 적용됩니다. 건조 필름 (그림 14a )은 대류 건조 중 부풀린 구조의 붕괴와 섬유의 응집으로 인해 훨씬 높은 안정성을 보여줍니다. 이 응집은 현탁액이 대류는 아니지만 동결 건조 될 때 훨씬 덜 집중적입니다. 이 경우에는 기계적 안정성 hemostyptic 또는 상처 드레싱 등 Matristypt으로 치과에서 사용되는 스폰지 이어지는 매우 낮은 ® , MBCollagen ® 또는 기타 [ 1 , 243 , 244 , 245 , 246]. 로드 베어링 어플리케이션에는 유용하지 않습니다. 필름 또는 스펀지가 건조하면 안정성이 높아져 수술 처리가 향상됩니다. 그러나 젖은 상태에서는 안정성이 다소 낮습니다. 가교가 습윤 상태에서 피부 샘플 및 콜라겐 필름의 기계적 안정성을 반드시 개선시킬 필요는 없지만 (도 14a ; [ 247 , 248 , 249 , 250 ]) 스펀지의 안정성은 어느 정도 증가한다 (도 14a ; [ 251 ]). 습윤 상태에서 원래 조직의 안정성은 필름 제조 또는 붕해 된 조직으로부터 제조 된 스펀지에 의해 다시 달성 될 수 없다. 신장 값은 파단 인장력 값에 반비례한다. 매개 변수 장력 파단 (UTS)은 샘플의 단면적을 참조하기 때문에 임상 적용과 관련하여 제한적으로 중요합니다. 가공 된 재료는 표 8에 요약 된 바와 같이 높은 값에 도달 할 수 있습니다 . 예를 들어 필름 (약 20 내지 100 마이크로 미터) 또는 작은 직경의 스레드 (약 50 내지 300 마이크로 미터)의 두께가 얇기 때문에, 파단 장력은 매우 낮지 만 파단 장력은 매우 높아질 수있다. 대조적으로, 콜라겐 스폰지는 다공성 구조 및 결과적으로 높은 두께로 인해 매우 낮은 값을 나타낸다. 콜라겐-풍부 조직, 세포 제거 및 추가 가공 된 물질의 극한 인장 강도 (UTS)풀 사이즈 테이블 파단시 힘 막의 스티치 인열 저항 스폰지 실제 조직.도를 비교하는 경우 15 )는 피부에 매우 안정 비교 소장 조직 예 콜라겐 현탁액으로부터 제조하는 필름이 값 근처의 인장 강도를 표시하는 것이 명백해진다 장과 같은 덜 안정적인 조직을 위해 달성되었습니다. 그러므로, 파 단력, 파열 강도 또는 스티치 인열 저항은 Deeken et al. [ 242 ]. 그림 15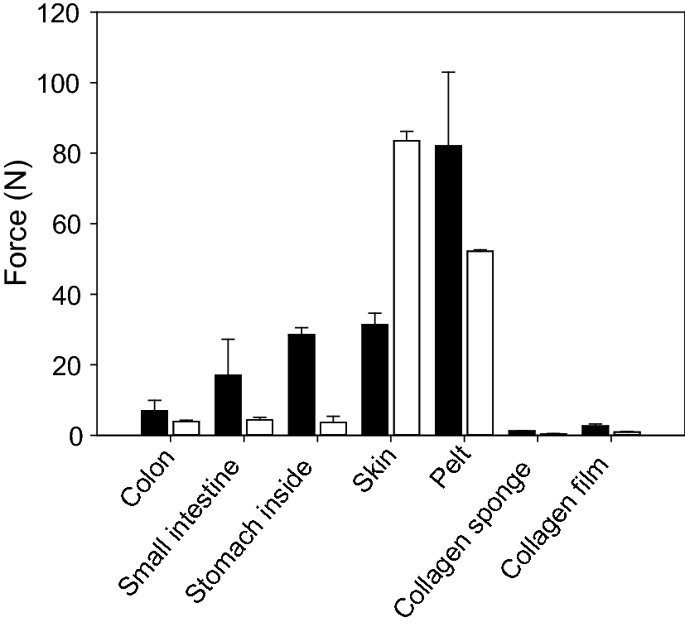 콜라겐 현탁액으로부터 제조 된 상이한 조직, 콜라겐 필름 및 스펀지의 습윤 상태에서 측정 된 극한 인장력 (흑색 막대) 및 스티치 인 열력 (백색 막대) [ 209 ] 효소 분해성의 공정 의존적 변화삼중 나선 콜라겐은 콜라게나 제를 제외한 많은 프로테아제에 안정적입니다. 추가의 가교 결합은 콜라겐을 추가로 안정화시킨다. 탈세 포화 된 돼지 진피 세균성게나 대하고 프로 나제, 써모 프로 테 K. 트립신 및 키모 트립신에 대한 감수성을 감소와 효율적인 기판으로서 작용하는 37 180 H 콜라겐 구조를 소화 할 수없는 ° C (도. 16 a). 완전히 테스트 된 모든 효소에 의해 열화를 진압 할 hexamethylendiisocyanate (HMDI)와 가교 (도. 16 b)뿐만 아니라 그 콜라게나 소량 (미공개 자체 조사; Permacol 유사한 재료 ® ). 그러나, 콜라게나 제는 더 높은 농도 (양 피부)에서 가교 된 조직을 분해한다 [ 239]. 인장 강도 및 변형은 효소 분해에 의해 안정한 한계까지 감소하는 것으로 밝혀졌다 [ 239 , 252 ]. 그림 16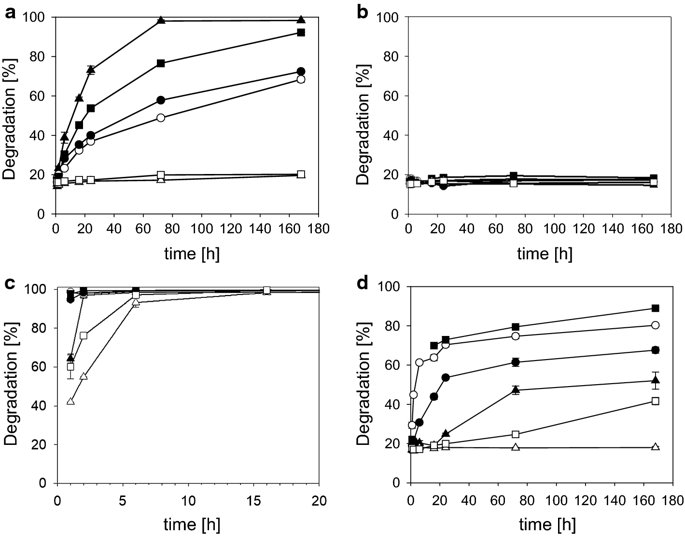 a , b 처리 시간, 효소가없는 효소 종류 (왼쪽) 및 합성 가교 (오른쪽)에 따른 돼지 가죽의 소화율; 채워진 삼각형 : 콜라게나 제 A; 개방 원 : 프로 테이나 제 K; 채워진 사각형 : 프로 나제 E; 열린 삼각형 : 트립신; 충전 된 다이아몬드 : 써모 리신; 광장 열기 : 키모 트립신. 동일한 효소 활성을 갖는 모든 실험 (미공개 자료 : Michaela Schroepfer, FILK). c , d처리 시간, 효소가없는 효소 종류 (왼쪽) 및 합성 가교 (오른쪽)에 따라 열처리 된 변성 돼지 가죽의 소화율; 채워진 삼각형 : 콜라게나 제 A; 개방 원 : 프로 테이나 제 K; 채워진 사각형 : 프로 나제 E; 열린 삼각형 : 트립신; 충전 된 다이아몬드 : 써모 리신; 광장 열기 : 키모 트립신. 동일한 효소 활성을 가진 모든 실험 (미공개 자료 : Michaela Schroepfer, FILK) 콜라겐의 삼중 나선이 변성 될 때 효소 분해성이 완화된다. 이어서, 단백질 사슬은 매우 짧은 시간 (도. 내의 모든 언급 된 효소에 의해 분해가 쉽게 취약 16 c). 화학적으로 가교 된 물질이 열에 의해 변성되면, 변성 및 가교가없는 것과 비슷한 시간 내에 (그림 16 d) 분해 될 수 있습니다 . 그러나, 그들의 활성 변화에 관한 효소의 순서 (Pronase; Proteinase K는 콜라게나 제보다 더 활동적임) 및 임의의 효소에 의한 분해는 180 시간 내에 완료된다. 명백하게, 가교는 습윤 상태에서의 기계적 특성 및 시험 관내 및 생체 내 콜라겐 물질의 분해 거동에 영향을 미친다. 이식 된 생체 물질은 숙주 조직과의 상호 작용의 집중적 인 캐스케이드를 유발한다 [ 28]. 첫 번째 반응 (분 내지 수 시간)으로서 지혈이 관찰되고 피브린이 풍부한 매트릭스가 형성되고,이어서 호중구 및 M1 유형 대 식세포의 면역 반응이 이어진다. 세포 파편이 분해되고, 병원체가 불 활성화되고, 스캐 폴드는 방출되는 수핵 펩티드 (일주일까지)를 분해하기 시작한다. M2 유형 대 식세포는 매트릭스를 침범하고 복잡한 세포 집단 (주에서 최대 몇 개월)에 의해 새로운 조직의 리모델링을 시작합니다. 따라서, 콜라겐의 분해 및 리모델링 거동은 M1 유형 및 M2 유형 대 식세포의 미세 조정 된 평형에 의해 야기된다. 따라서, 생체 내 분해를 연장시키기 위해 수행되는 추가적인 화학적 가교가 논란의 여지가있다. 임상 적 관점에서, 다양한 저자 [ 253 , 254 , 255 ]는 가교 된 물질에 대한 집중적 인 염증성 반응, 흉터 형성, 캡슐화 및 낮은 혈관 화의 위험 때문에 화학적 가교를 완전히 피할 것을 권장한다. 반대로 Dunn [ 256]는 최근의 임상 연구에서 여전히 임상 연구가 누락되고 동물에 대한 생체 내 시험에서 비슷한 조건이 부족하며 기존 결과가 충분히 일관성이 없다고 최근 검토에서 주장했다. 임상 적용 및 임플란트의 기능에 따라, 가교는 시간에 따른 강도, 주변 조직에서의 통합 및 리모델링의 속도 및 유형과 같은 물리적 특성과 관련하여 유리한 것으로 보인다. 로타 멜 (Rothamel) 등. [ 254 ]는 생체 내에서 가교 결합 및 가교 결합없이 다르게 제조 된 생체막의 분해를 비교 하였다 (표 9 ). 래트의 뒷면에 피하 주머니에 샘플을 할당했다. 추가로 가교되지 않은 돼지 막은 2 내지 4 주 후에 통합되고 혈관 화되는 반면, 고도로 가교 된 힘줄 기반 막은 24 주 동안 완전히 통합되고 혈관 화되지 않았다. 대조적으로, 생분해는 콜라겐이 화학적으로 안정화 될수록 더 강하게 낮았다. 시험 관내에서 효소 분해에 대한 측정 된 안정성은 시간 규모가 완전히 상이하지만 생체 내에서 정 성적으로 확인할 수 있었다. 생체 내 분해는 이상적인 조건에서 시험 관내보다 훨씬 더 긴 것으로 관찰된다. 형성다양한 임상 응용 분야에 대해 다른 복잡성을 가진 임플란트를 제조하기 위해 임상 성공의 최종 목표를 달성하기 위해 세 가지 전략을 세분화 할 수 있습니다. - 1.
멤브레인 또는 스폰지와 같이 이미 시판 된 간단한 구조의 공급. 이들 구조의 탈세 포화는 수년간 피부, 연골, 뼈, 심낭 또는 장과 같은 조직 부분으로 수행되어왔다. 이 기술은 확립되어 많은 시판 제품 [ 3 , 20 , 257 , 258 , 259 ]으로 이어지고, 피부, 연골 또는 뼈 대체, 치과 용 또는 멤브레인 구조 만 필요한 경우 혈관이 낮은 지역의 외과 의사에 의해 사용됩니다. . 일반적으로 외과의는 임상 적 필요에 따라 스폰지 또는 막과 같은 생체 물질의 간단한 구조를 조정하고 주변 수용 조직은 이식 된 물질을 재 혈관 화하고 대사합니다. - 2.
저장된 혈관 나무를 포함하는 탈세 포화 된 기관으로서 복잡한 구조의 공급. 20 년 동안 전체 장기의 탈세 포화는 심장, 간, 폐, 뇌, 신장 및 기타와 같은 전체 장기의 무 세포 스캐 폴드로서 인상적인 결과를 제공 하였다. 이러한 연구는 장기의 복잡한 구조, 특히 혈관 네트워크 및 구조물의 기계적 안정성 [ 18 , 23 , 214 , 218 , 260 , 261 ] 및 기타 를 저장하는 것을 목표로 했습니다. 그러나, 최근의 논문은 전체 기관의 탈세 포화 [의 명백한 단점을 설명합니다 (28)]. 구조의 최종 순도를 제어하는 것은 매우 어렵고 혈관의 복잡한 구조와 모세관은 재 세포 화가 어려운 과제로 남아 있습니다. - 삼.
이 둘 사이의 하이브리드 구조는 정제 된 중간체를 기본으로합니다. 공학적 관점에서 그리고 그러한 하이브리드 스캐 폴드 또는 조직 구성 요소를 제조하기위한 목적으로, 조직은 3 가지 기본 형상으로 축소 될 수있다 [ 209 ]. 이들은 신체의 다른 부분에서 발견됩니다 : 간, 신장, 폐, 뼈, 연골과 같은 부피가 큰 다공성 구조뿐만 아니라 가장 넓은 의미의 근육과 피부; 심낭, 복막, 방광, 피부의 일부 (예 : 표피), 장과 같은 막 구조; 마지막으로 다양한 치수 나 신경의 혈관과 같은 튜브형 구조입니다. 이 견해는 물론 단순화와 확대의 문제입니다. 예를 들어 현미경으로 볼 때 장 조직은 막처럼 보이고 완전한 단면에서 튜브로 지정되어야합니다.
후자의 전략에는 다른 성형 기술이 필요합니다. 자유롭게 성형 가능한 페이스트, 겔, 시트 또는 분말로 추가로 분해되는 조직 기반의 무 세포 중간체 [ 7 , 27 ]는 필름, 튜브, 다공성 폼 및 다양한 다공성의 복합 재료, 멤브레인 형 구조로 다양한 부분으로 형성 될 수 있습니다. 중공 섬유가 포함 된 스폰지를 덮습니다. 성형 기술은 압출, 몰드 캐스팅, 사출 성형, 텍스타일 기술, 전기 방사를 포함하고 매우 복잡한 구조를 제조 할 수있는 적층 제조 기술로 끝납니다 [ 13 , 209 , 222 , 262]. 이 전략은 크기, 디자인 및 재료와 관련하여 큰 위도를 허용하지만 선박 나무 또는 신경총과 같은 복잡한 모양의 재 설계가 부족합니다. 복잡한 구조는 생체 외 또는 생체 내에서 세포 시딩에 의해 생물학적 수단에 의해 재건 될 것으로 추정 될 수있다 [ 263 ]. 압출압출은 다이를 통해 고점도 덩어리를 누르는 것을 의미합니다. 이 기술은 플라스틱 산업에서 합성 열가소성 폴리머를 복잡한 디자인의 스트랜드로 형성하는 데 널리 사용됩니다. 다이는 단지 원통형 스트랜드, 필름으로 이어지는 편평한 다이 또는 튜브를 제조하기위한 링형 다이를 야기하는 홀일 수있다. 차가운 상태에서 회전 설비를 갖는 다이를 통한 콜라겐 현탁액의 압출의 경우, 콜라겐 섬유는 특정 각도로 배향되어 이러한 조정없이 압출에 의한 것보다 다양한 방향으로 더 높은 기계적 안정성을 제공한다 [ 2 , 222 ]. 차가운 상태에서 콜라겐 덩어리의 튜브 압출은 소시지 케이싱을 제조하기 위해 수십 년 전에 처음으로 확립되었다 [ 219 ]. 콜라겐 현탁액은 또한 실 및 필라멘트를 제조하기 위해 압출된다 [ 13 , 232 , 264 , 265 ]. 열간 압출에 의해 열가소성 콜라겐 ( 232) 을 가공하는 것도 가능했으며 , 냉간 및 열간 상태에서의 압출은 적층 제조를위한 성형 기술 일 수도있다 [ 13 , 266 , 267 ]. 금형에서 주조감산 가공 또는 스탬프에 의해 제조 된 몰드는 성형품을 제조하는데 사용된다. 후자의 기술은 와인 껌을 제조하는 데 사용됩니다. 다른 첨가제, 예를 들어 아로마, 설탕 및 시트르산을 함유하는 고점도 젤라틴 용액은 금속 산업에서 모래 주조와 유사한 전분 분말 베드에 의해 제조 된 몰드에 부어진다. 포지티브 몰드는 석고 블록에서 절단하여 제조됩니다. 네거티브 몰드는 한 번만 영구적으로 사용됩니다. 영구 주형은 콜라겐 현탁액과 다른 모양의 스폰지 형 구조를 제조하는 데 사용됩니다. 점성 제제를 구멍에 붓고 동결 건조시켰다. 주형은 대부분 건조 전에 동결 공정 속도를 높이기 위해 금속으로 만들어집니다. 콘 및 실린더는 치과 용 (Parasorb cone ® ) 및 젤라틴 (Gelita-Spon ® )의 큐브 형 스폰지 용으로 생산됩니다 . 몰드는 또한 적층 제조 ( 268 )에 의해 또는 수공에 의해 만들어져 보다 복잡한 형상, 예를 들어, 귀 또는 방광 유사 구조를 달성한다 [ 269 , 270 ]. 사출 성형사출 성형은 열가소성 중합체의 핫 멜트를 금형에 주입하여 3D 제품을 제조하는 경제적 인 기술을 설명합니다. 이어서이 몰드를 냉각시키고 응고 된 물품을 거부한다. 클럭 속도는 제품의 크기와 냉각 방식에 따라 몇 분에서 몇 초까지입니다. 콜라겐은 처음에는 열가소성 물질이 아니지만, 열가소성 중간체는이 기술에 의해 성형 될 수있다 [ 205 , 230]. 부분 변성, 후속 분쇄 및 압출은 열가소성 콜라겐으로부터 물품, 예를 들어 애완 동물 사료와 같은 작은 형상이지만 딱딱한 물품을 제조 할 수있게 하였다. 레시피에는 가소제로서 부분적으로 변성 된 콜라겐, 물 및 글리세롤 만이 함유되어 있습니다. 제제는 또한 히드 록시 아파타이트와 혼합되어 의료 적용을위한 뼈 유사 구조를 제조 할 수있다. 건조 후 글리세롤을 첨가하지 않은 상태에서 물품은 뼈와 같고 매우 강해졌다. 섬유 기술과거에는 콜라겐을 실 또는 필라멘트로 옮기기 위해 많은 시험이 수행되었습니다. Catgut는 수세기 동안 수술 용 재봉사로 사용되어 왔으며 Franz Kuhn은 순도에 따라 모든 제조 단계를 입증하여 재료를 완전히 소독 할 수있는 최초의 사람이었습니다 [ 271 ]. Catgut는 염소 또는 양의 장과 다른 포유류의 줄무늬로 제조되었으며, 이들은 기계적으로 정제되고, 세포질이 제거되고, 석회화되고, 원통 모양이 달성 될 때까지 비 틀리고 장력하에 건조된다. 신체의 분해 속도를 조절하기 위해, 현은 크롬 염으로 가교되었다. 같은 재료가 악기의 줄로 사용되었고 외과의가 상처를 막기 위해 사용했습니다. 여러 개의 줄무늬를 함께 접착함으로써 충분한 야드를 가진 실을 제조 할 수있었습니다. Catgut는 신체에서 완전히 분해 가능하며 높은 강도와 높은 탄성을 보여줍니다. 그러나 소 해면 성 뇌병증 (BSE)의 위험과 합성 대안이 생겨 의료 시장에서 사라졌다 [ 272 , 273 , 274 ]. 콜라겐은 섬유질 단백질이지만, 양모, 실크 또는 셀룰로오스와 같은 다른 천연 섬유와 같이 직접 방사에 의해 장 섬유를 제조하는 것은 불가능하다. 콜라겐은 섬유질 물질 (양모, 실크)로 자라지 않으며 고농축 용액에서 방사되도록 풀 실질로 풀리지도 않습니다. 그럼에도 불구하고, 높은 야드의 섬유를 생산하는 세 가지 방법이있다 [ 232 , 265 ] (및 인용 된 문헌). 먼저, 저 농축 용액으로부터 스핀 콜라겐을 용매로 회전시키고 유기 용매 또는 수성 염 용액에서 섬유를 침전시킬 수있다. 글루 타르 알데히드, EDC 또는 이소시아네이트에 의한 가교는 다소 안정한 섬유를 초래한다. 두 번째 방법은 섬유질로 압출 된 탈세 포화 된 다진 가죽 또는 힘줄의 콜라겐 현탁액을 사용하는 것입니다. 원리는 소시지 케이싱을 제조하기 위해 수십 년 전에 설립되었지만 튜브 (케이싱)에서 실린더 (스레드)까지 쉽게 조정할 수 있습니다. 부은 입자와 섬유가 방사 노즐을 통과 할 수 있도록 콜라겐 원료를 충분히 잘라내는 것이 문제입니다. 방사 된 섬유는 용매 방사 된 섬유로서 침전되고 가교되어야한다. 세 번째 기술은 열가소성 콜라겐의 용융 압출입니다. 여기서 콜라겐이 변성되고 용융 방사가 열가소성 합성 중합체의 방사와 유사하게 수행되기 때문에 콜라겐의 1 차 섬유질 구조가 손실되었다. 결과 콜라겐 필라멘트는 건조 상태에서 매우 안정적이지만 습도에 매우 민감하고 가습시 안정성을 잃습니다. 그러한 필라멘트를 편직하고 직조하는 것이 가능하지만, 자수 및 재봉은 바늘의 눈을 통과 할 때 실의 안정성이 매우 높고 실 파손이 매우 자주 관찰된다. 세 가지 기술 모두 이러한 필라멘트로부터 직물을 제조 할 수 있지만 모든 콜라겐 직물의 습윤 안정성은 다른 필라멘트로 달성 될 수있는 것만 큼 높지 않다 [ 232 , 275 ]. 전기 방사전기 방사는 강한 전기장에서 다이를 통해 폴리머 용액 또는 용융물을 방출함으로써 나노 섬유 부직포를 제조하는 기술이다. 이탈하는 액 적은 변형되고 지지체 상에 증착 된 필라멘트를 형성한다. 필라멘트를 다이에서 지지체로 이송하는 동안 용매를 제거해야합니다. 콜라겐 용액은 용매로서 1,1,1,3,3,3- 헥사 플루오로 -2- 프로판올을 사용하여 이미 적용되었다 [ 276 , 277 , 278 ]. 콜라겐이 수용액에서 방사되면, 일반적으로 변성된다 [ 279]. 희박한 조사 만이 3 중 나선 구조를 절약하면서 독성 불소화 용매를 비 독성 용매로 성공적으로 교환했습니다. 저자들은 수성 에탄올, 염화나트륨 또는 폴리 비닐 알코올의 혼합물을 사용했으며 의료 분야에서 첫 번째 적용, 예를 들어 유도 뼈 교체가 준비되고있다 [ 280 , 281 , 282 ]. 전기 방사는 용액에서만 작동합니다. 점도가 너무 높아서 얇은 필라멘트로 압출 될 수없고, 용매로서 물 또는 수성 산이 응집을 방지하기에 충분히 증발 될 수 없기 때문에 콜라겐 현탁액은 이러한 방식으로 방사 될 수 없었다 (비공개 결과). 첨가제 제조적층 가공 (AM)은 절단 및 가공 (감산 기술) 또는 몰딩이 아니라 부가 기술에 의해 3D 물품을 구성하는 기술이 빠르게 증가하고 있습니다. 금속과 세라믹도 가공되지만 폴리머는 가장 많이 사용되는 재료 등급입니다 [ 283]. AM 기계는 silico에서 완전히 생성하거나 이미징 절차 (예 : X-ray, MRT, 표면 스캔)를 기반으로 생성 할 수있는 CAD 기반 데이터 세트가 필요합니다. 이러한 가상 모델은 AM (layer by layer) 기술로 구현되도록 형식화해야합니다. AM 기술은 광중합 (입체 리소그래피), 분말 층 융합 (SLS), 재료 및 바인더 분사 (잉크젯 및 에어로졸 3D 프린팅), 시트 라미네이션 (LOM), 압출 (FDM, 3D 디스 펜싱, 3D 섬유 증착 및 3D 플로팅) 및 3D 바이오 프린팅. 기술 원리와 가능한 재료는 최근 에 금속, 세라믹 및 합성 중합체와 같은 합성 재료 에 관한 원리 [ 284 ] 에 초점을 맞춘 다수의 간행물에 요약되어있다 [ 285], 바이오 잉크 [ 283 , 286 , 287 , 288 , 289 ]를 포함한 기계, 프로세스 및 재료에 대해보다 포괄적으로, 마지막으로 부품 또는 전체 장기의 제조 [ 290 , 291 , 292 , 293 , 294 , 295 ] 지난 몇 년 동안의 선택을 인용하십시오. 다른 중합체없이 단독으로 가공 된 콜라겐과 그 유도체 젤라틴에 초점을 맞출 때, 비록 두 물질이 생물학적 측면에서 매우 적합하지만, 아직 덜 출판되었다 [ 296 ]. 단점은 콜라겐의 야심 찬 가공과 열적 특성입니다. 열가소성 콜라겐은 압출에 필요한 열가소성으로 실제로 작용하지 않습니다. 낮은 점도를 얻기 위해 더 높은 온도에서 녹는 합성 열가소성 폴리머와 달리 열가소성 콜라겐은 껌과 유사하게 작용하며 전단 하에서 압출되어야합니다 [ 205 , 230]. 이를 위해 적합한 플로팅 머신이 아직 개발되지 않았습니다. 젤라틴 용액은 따뜻한 용액으로서 점도가 매우 낮습니다. 설정이 가능하지만 적절한 처리 시간을 달성하기에는 너무 느립니다 (분에서 최대 시간). 삼중 나선 콜라겐 용액은 차가운 상태에서 점도가 낮으므로 가열을 피해야합니다. Panwar와 Tan [ 297 ]은 이러한 처리 어려움을 극복하기위한 다양한 접근 방식을 요약했다. 젤라틴은 습윤 상태에서 더 높은 안정성을 달성하고 분해 속도를 감소시키기 위해 메타 크릴 레이트 화되었다 [ 292 , 298 , 299 , 300 ]. 또한, 젤라틴은 히알루 론산 [ 300 , 301 ], 알기 네이트 [ 302 ], 피브린 [ 303 ], 키토산 [ 304 ] 및 실크 [ 305 ] 와 같은 다른 바이오 폴리머와 결합 되었지만 폴리에틸렌 글리콜 [ 306 ]과 결합되었다.]. 이들 혼합물은 스트랜드가 증착 될 수 있도록 점도를 증가시키는 것을 목표로 하였다. Ca2 +- 이온 을 함유 한 물 배치에서 젤라틴 알기 네이트 혼합물을 침착시킴으로써 알기 네이트를 고화시켰다 . 콜라겐 제 폴리에틸렌 - 폴리 프로필렌 공중 합체 [결합 콜라겐 용액으로부터 재조합 겔을 사용 하였다 307 ] 상기 언급 다른 생체 고분자의 대부분과, 그들 중 일부는 또한 허용 아크릴기로 변성되는 광 가교 [ 297 , 308 , 309 , 310 ]. Kim et al. [ 311 ] 응고 압출 아테로 냉각 된 접시 용액 증착함으로써 아세트산 (건조 물질 함량 4.5 %)에 용해 - 40 ° C를. 이어서, 냉동 된 스캐 폴드를 해동시키지 않고 동결 건조시키고, 에탄올 중의 EDC로 동결 건조한 후 가교시켰다. Pati et al. [ 312 ]는 차가운 상태에서 물리적으로 균질화, 동결 건조, 펩신 화, 여과 및 중화 된 탈세 포화 된 돼지 심장 및 연골을 사용 하였다. 생성 된 현탁액은 저온 상태의 세포와 조합 될 수있다. 바이오 잉크 세트의 온도를 증가 시키지만, 안정적인 구조를 달성하기 위해 바이오 잉크는 폴리 카프로 락톤 스트랜드와 조합되어야했다. Jose et al. [ 313 ]은 고급 바이오 잉크에 대한 요구 사항을 공식화했다. 장기간 생체 적합성 및 생분해 성이 있어야하며, 발판으로 작용하며 생물학적 및 구조적 특성의 균형을 유지해야합니다. 이러한 요구 사항을 충족하기 위해 구조 및 생물학적 구성 요소를 결합하여 증착했습니다. 자체 시험에서 콜라겐과 젤라틴을 공 증착하여 생체 적합성 구조를 제조 하였다 [ 267]. 콜라겐 현탁액은 차가운 상태에서 탈세 포화 된 돼지 피부 분열을 기계적으로 깎아서 제조 한 다음과 아세트산으로 멸균하여 제조 하였다. 세포 적합성 제제를 달성하기 위해, 수산화 나트륨을 첨가하여 산성 덩어리를 중성 pH로 조정 하였다. 섬유의 침전은 250 mmol / L TrisHCl (pH 8)의 첨가에 의해 억제되었다. 이러한 제제는 습식 압출에 의해 바이오스 캐 폴더 (GESIM, Radeberg, Germany)로 직접 플롯 될 수있다. 섬유 아세포 세포 현탁액을 PBS 중의 따뜻한 (20 ℃) 젤라틴 용액 (2 %)으로 이루어진 바이오 잉크로 적용 하였다. 소량의 재 조립 된 콜라겐을 첨가함으로써 세포의 침강을 방지 하였다. 이러한 조합은 구조 형성 중합체 성분으로서 다른 중합체 첨가제없이 콜라겐 및 콜라겐 유도체만을 기초로 한 공정에서 생세포를 갖는 복잡한 3D 구조를 직접 제조 할 수있게 하였다. 미래에이 기술은 개별 조직 유사 구조를 제조하는데 사용될 수있다. 사양 및 한계콜라겐의 가공에는 가공 된 물질의 순도에 대한 목표 한계가 필요합니다. 시판 될 의료 응용을 위해, 이들 물질은 종종 표준, 예를 들어 ASTM F2212-11 및 인용 된 ASTM, ISO 및 유럽 표준에 따라 특성화된다. 이 표준은 분석 방법을 요약하지만 한계는 거의 없습니다. 임상 적으로 사용되는 물질에는 생존 가능한 미생물 박테리아 오염이 없어야한다는 것이 당연한 사실이다 [ 210 ]. 이것은 적절한 멸균으로 달성됩니다. 콜라겐과 관련하여 이것은 도전이 될 수 있으며 제품 개발 초기에 계획되어야합니다. 또한, 내 독소 함량은하기 기술 된 바와 같이 기술적으로 달성 될 수있는 정부 규정 ( http://www.fda.gov ) 에 따라 0.5 EU / mL 추출물 및 20 EU / 장치로 제한 된다. 세포 독성은 일반적으로 XTT 시험을 사용하여 재료 또는 용출액에서 직접 측정됩니다. 시험 전에 pH를 조정하고 과잉의 처리제, 예를 들어 과산, 과산화수소, 염 또는 살균제가 세포 독성 결과를 초래하지 않는지 확인하는 것이 중요합니다. 달성되어야하는 순도는 탈세 포화 된 조직으로부터 잔류하는 생물학적 성분, 및 유기 및 무기 가공 화학 물질의 잔류 물을 포함한다. Londono와 Badylak [ 28 ]은 50ng DNA / mg 건조 중량의 상한 , 200bp를 초과하는 DNA 단편, 충분한 순도의 마커로 Hämatoxylin / Eosin 또는 DAPI에 의해 염색 된 가시 핵이 없음을 권장했다. 이러한 한계는 생물학적 요구 사항은 아니지만 충분한 화학적 세척을 나타내는 데 사용되었다 [ 314 ]. 지방과 지질은 일반적으로 가능한 한 많이 제거되며 추출 및 크로마토 그래피 분석으로 감지 할 수 있습니다. 무기 성분의 잔존물은 쉽게 측정 할 수 있습니다 (AAS, REM-EDX, IC 등). 으로 ToF-SIMS 분석은 [위한 강력한 도구가 될 보이지만 그러나, 고효율 유기 첨가제, 계면 활성제, 특히 효소 및 응용은, 검출하기 어려운 172 ]. 다른 비-콜라 게노 우스 잔해물은 불순물과 같은 논란의 여지가 있거나 또는 가공 동안 저장되거나 제거되어야하는 원하는 성분, 예를 들어 결합 탄수화물, 성장 인자 및 엘라스틴과 같이 논의된다 [ 27 , 315 ]. 그러나 복잡한 화학 제조 공정에서 특정 구성 요소를 재현 가능한 품질로 선택적으로 유지하는 것은 어려운 일인 것 같습니다. 아마도 약물 전달 시스템에 이미 확립되어 있기 때문에 집중 정제 후 선택된 첨가제를 첨가하는 것이 더 효과적 일 것입니다. 기능적 특성과 관련하여 콜라겐의 출생을 감지하는 것이 합리적입니다. 이는 지혈 성 행동, 분해성 및 기계적 견뢰도와 같은 많은 특성과 직접적으로 연관 될 수 있기 때문입니다. ΔH D 는 DSC로 측정 할 주요 매개 변수입니다. 네이티브 포유류 수용성 콜라겐 쇼 ΔH D 50 / g 콜라겐 [J 60의 132 , 316 ]. 가교는 DSC 및 용해도 측정과 함께 아미노산 분석에 의해 검출 될 수있다. T 가교 D의 비 - 가교 된 물질에 비해 증가 (예 : 리신) 아미노산 사라지게하고 선택된 프로테아제에 대한 용해도 및 감도를 감소시킨다. 콜라겐 조직 처리 – 도구와 그 효과바이오 물질을 제조하기위한 콜라겐이 풍부한 조직의 가공은 수십 년에 걸쳐 개발 된 몇 가지 원칙을 따릅니다 (그림 11 ). 일반적으로, 목적은 비 구조 형성 성분으로부터 가능한 한 조직을 유리하게하는 것이다. 생성 된 재료는 다른 형태로 가공되고 종종 건조 및 멸균됩니다. 그러나 사용 된 기술에 따라 멸균은 구조 및 화학적 특성에 다시 영향을 미칩니다. 다음 섹션에서는 여러 가지 단일 단계가 최종 재료 특성에 미치는 영향에 대해 설명합니다. 기계적 처리종종 기계적 수단에 의해 표적 조직의 원하지 않는 부분을 제거하는 것이 편리하다. 이것은 심낭, 힘줄 또는 요로 방광 인력과 같은 많은 소규모 준비에 대해 수행되지만 수동 원료는 식품 및 가죽 산업에서 사용되기 때문에 장과 피부에 자동 방법을 사용할 수 있습니다. 플레 싱 및 분할 숨기기기계적 단계 플레 싱 및 스 플리 팅은 피부를 정화하고, 원치 않는 구조를 제거하고, 두께를 조정하는 데 사용됩니다. 플레 싱은 회전 나이프 실린더로 지방 조직을 면도함으로써 피하 조직을 제거합니다 [ 317 ]. 운반 롤에 의해 피부가 기계에서 이동 및 제거됩니다. 스킨은 나이프 실린더와지지 롤 사이에 적용되고 후자에 대해 가압된다. 회전 나이프 실린더는 뒷면에서 지방 조직과 근육 및 느슨한 결합 조직을 제거합니다. 자체 시험에 따르면 돼지 피부 등의 지방이 롤에 의해 종종 망상으로 압박되어 콜라겐 구조 내부의 지방 함량이 높아지는 것으로 나타났습니다. 이 경우 가죽을 분리하여 지방을 제거하는 것이 유리합니다. 쪼개지는 기계는 소, 돼지 또는 말 소스로부터 전체 피부를 최대 5 제곱미터의 면적에 걸쳐 0.3 mm 두께의 쪼개기로 분할하는데 사용될 수있다. 고무로 만든 두 쌍과 황동으로 만든 어셈블리로 배열 된 두 쌍의 특정 운반 롤은 가죽을 기계로 운반합니다. 분할은 연속적으로 날카롭게하는 회전 밴드 나이프에 의해 달성된다 [ 317 ]. 대안 적으로, 클리닉에서 피부과는 피부 자동 이식을 준비하기 위해 외과의에 의해 사용됩니다. 이 피부병은 고정 또는 진동 블레이드가있는 절단 나이프로 작동하며 작은 피부 줄무늬를 생성하는 데만 사용할 수 있습니다. 소장 점막의 탈피 (SIS)SIS를 준비하기 위해, 돼지 또는 다른 포유 동물의 내장은 도살장에서 제공되며 세척과 결합 된 롤 시스템에서 기계적으로 처리됩니다. 이러한 방식으로 점막하 점막은 점막 및 근육 조직과 같은 다른 성분으로부터 넓게 제거됩니다. 기계적으로 유리 된 점막하 층은 pH 스위프 및 다른 작용 제로 피부와 유사하게 처리된다. 마이닝 및 균질화Collagenous 조직, 특히 피부 및 힘줄은 필름 또는 폼으로 성형되기 전에 현탁액으로 균질화됩니다. 이러한 섬유질 콜라겐 현탁액을 제조하는 동안 물리적 처리 다듬기, 분쇄 및 균질화가 핵심 단계이다. 절차는 일반적으로 테니스 공처럼 유동성에서 뻣뻣한에 이르기까지 점도가 매우 높은 부풀어 오른 콜라겐 섬유 덩어리로 끝납니다. 건조물 함량은 0.5-10 % 사이입니다. 이들은 전단 박화 거동을 보이며 점도는 pH, 건조 물질 함량 및 기계 밀링 강도에 따라 달라집니다. pH를 5.5보다 높게 조정함으로써, 콜라겐 섬유가 침전되고 물이 분리된다 [ 200 , 267 ]. 일반적으로 섬유질 덩어리의 준비는 삼중 나선 구조를 절약하는 것을 목표로합니다. 따라서 모든 생산 단계의 소재가 T D 보다 높은 온도 (또는 로컬)에서 나오는 것을 방지하는 것이 중요합니다 . 팽윤도 T DpH 의존성이 높기 때문에, 특히 균질화 단계를 미세하게 조정해야합니다. 기계에는 육류 산업에서 알려진 강력한 냉각 기술이 필요합니다. 미트 초퍼는 원료가 이미 화학적으로 정제 된 첫 번째 단계에서 거친 분쇄에 사용됩니다. 케이싱 산업에서 사용되는 산업적으로 적용되는 균질화 기술은 "건식"공정과 "습식"공정으로 구분됩니다. "건조물"은 일부 첨가제를 갖는 수성 시스템에서 10 내지 15 %의 건조 물질 함량을 의미한다. "습식"공정은 일반적으로 5 % 미만의 건조 물질 함량으로 작동합니다 [ 318 ]. "습식"공정 동안 균질화가 콜로이드 밀로 달성되는 반면, "건식"공정 동안 고도로 팽윤 된 섬유의 사전 조정 된 질량은 수백 bar의 매우 높은 압력을 갖는 일련의 천공 디스크를 통해 균질화된다. 결과 질량은 특히 섬유 길이와 관련하여 다릅니다. "건식"가공 된 섬유는 더 두껍고 수 센티미터 길이 일 수있다. 질량이 콜로이드 밀에서 균질화 될 때, 수백 마이크로 미터가 달성된다 [ 219 , 318 ]. 섬유 분포는 상당히 다양하며 두 공정 변형 모두에서 매우 광범위합니다. 건조 된 조직으로부터 실제 건조 분쇄 (건조물 함량> 85 %)도 가능하다 [ 27 , 319 ]. 이는 습식 수성 시스템에서 재 팽창 될 수 있고 "습식"공정에 대해 기술 된 것과 유사한 기술에 의해 균질화되는 솜처럼 부피가 큰 중간체로 이어진다. 최근 Terzi et al. [ 320 ]은 상이한 상업적 말, 힘줄 유래 섬유질 콜라겐 중간 물질, 구조적 정보 및 제조 된 필름의 생물학적 특성 사이의 상관 관계를 기술 하였다. 불행히도, 섬유 중간체의 제조 기술은 정확하게 제시되지 않았다. 공정, 섬유 제조 단계 기술 및 선행 기술이 최종 재료 특성에 현저하게 영향을 미치기 때문에 이러한 결과를 평가하는 것은 어렵다. 물리 치료추출, 온도 처리 및 방사선과 같은 물리적 처리는 다른 구조 수준에서 콜라겐에 영향을 미칩니다. 추출Nageotte [ 321 ]은 처음에 삼중 나선 콜라겐이 유기산에 의해 어린 조직에서 추출 될 수 있다는 것을 발견했으며, 오늘날까지 가용성 콜라겐의 제조 원리는 크게 변하지 않았다. Collagenous 조직은 완충 용액과 유기산에 부분적으로 만 용해되며 콜라게나 제를 제외하고 단백질 분해 소화에 대해 크게 안정적이다 [ 322 ]. 산 및 프로테아제에 대한 감수성은 나이가 증가함에 따라 감소하며 [ 323 ] 이는 조직의 특이적이고 비특이적 자연 가교의 결과이다 [ 77]. 용해도는 또한 종에 따라 크게 좌우됩니다. 6 개월 된 송아지의 피부에서 최대 10 %의 콜라겐을 추출 할 수 있으며 비슷한 노화 된 동물의 돼지 피부는 거의 불용성입니다 (<0.5 %). 어류의 피부는 용해성이 높으며 ( 324 , 325 , 326 , 327 ) 한 번에 50 % 이상을 추출 할 수 있습니다. Atelocollagen은 산성 용액에서 펩신으로 콜라겐이 풍부한 원료 (피부, 힘줄)를 처리하여 생성됩니다. 비-나선형 텔로 펩티드는이 영역에서 가교 결합을 포함하여 소화되며, 삼중 나선 분자 부분 (예 : 인간 α1 (I), 위치 179-1218) 만 해결되고 약산으로 추출하는 것보다 수율이 더 높습니다 [ 2 ]. 이 telopeptides의 소화는 상대적으로 느립니다. 이를 완전히 제거하려면 24 시간 이상의 반응 시간이 필요합니다. 아미노산 분석을 통해 어느 정도 성공을 분석적으로 제어 할 수 있습니다 (표 3), α1 (I)의 텔로 펩타이드에서 티로신은 위치 165 및 167 (N- 말단) 및 1215 및 1216 (C- 말단)에서만 발견되므로 삼중 나선 영역 외부에 있지만 직접적으로 인접하지는 않습니다. 트리플 헬리컬 영역. 인간 콜라겐 I의 α2 사슬은 삼중 나선 부분에 단 하나의 티로신을 함유한다. 분석에서 티로신이 하나만 달성되면 텔로 펩타이드는 적어도 부분적으로 소화되어야합니다. 마지막으로, 원료를 알칼리성으로 처리하면 아미드 글루타민 및 아스파라긴이 상응하는 산 글루탐산 및 아스파르트 산으로 전달된다. 이 용해성 콜라겐은 데 사미도 콜라겐 (desamidocollagen)이라고하며 알칼리 처리없이 섬유소 형성력이 감소 된 콜라겐에 비해 현저히 낮은 IEP를 보입니다 [ 328 ]. 온도콜라겐은 다양한 온도에 노출 될 때, 세 개의 범위가 고려되어야한다 : (1) 사이에 해동 T (2)의 물 온도 차는보다 낮은 또는 버퍼 D (3) T보다 높은 D . 동결 건조시 동결 온도보다 낮은 온도가 중요합니다. 약 35 % m의 물 / m 건조 물질이 콜라겐에 결합되고 동결되지 않습니다. 결합 수는 -60 ° C 미만의 온도에서만 응고됩니다 [ 329 , 330 , 331 ]. 이것은 기계적 성질과 콜라겐의 높은 구조가 동결에 의해 약간의 영향을받는 이유 일 수 있습니다 [ 20 ]. 탈세 포화 프로토콜에서 종종 동결 및 해동주기는 물리적 수단에 의해 세포를 효과적으로 손상시키기 위해 사용된다 [ 20 , 332 , 333]. 여러 사이클이 하나보다 효과적입니다. 그러나 동결 및 해동 속도뿐만 아니라 동결이 끝나는 온도는 공개되지 않았습니다. 매우 높거나 매우 낮은 동결 속도가 더 집중적 [세포 손상을 것을 그것은 예상되는 334 , 335 ]. 아마도,주기의 수뿐만 아니라 동결 및 해동 속도는 탈세 포화 효율에 영향을 줄 것이다. 제로 섭씨와 T 사이의 온도 범위 D에서는 삼중 나선 구조는 습식 처리 및 성형 동안 저장 될 때 목표 중요한 프로세스 윈도우이다. 이 범위와 관련하여 모든 공정 단계를 조정해야합니다. 이것은 또한 예를 들어, 다지기, 밀링 또는 절단 단계에서의 국부적 온도 변화에 관한 것이다. T D 는 건조 물질 함량뿐만 아니라 pH 의존성 인 팽창도 (도 17 )에 의존한다. T D는 로컬 때문에 균질 재료에 분산되지 hydrotropica, 산 또는 알칼리의 적용이 감소된다. 따라서, T 충분히 상이한 처리 온도 D가 고려되어야한다. 그림 17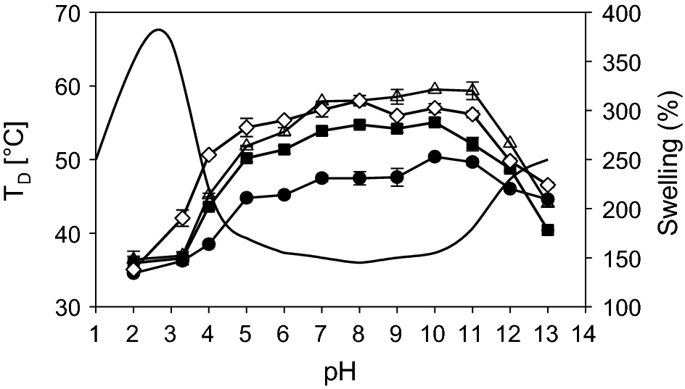 변성 온도 T D [ 347 ] 콜라겐의 다양한 형태 및 양 피부 [팽윤 343 ]의 pH에 따라; T D : 열린 삼각형 : 쥐 꼬리 힘줄; 채워진 원 : 가용성 콜라겐; 채워진 사각형 : 돼지 가죽; 오픈 다이아몬드 : 소 가죽; 부종: - 전달 T D는 트리플 나선 잠금을 해제합니다. T D가 미소 섬유의 수분 함량에 따라 결정 구조 (풀리는 섬유의) 조직, 산도, 또한 가교도 [대응되는 135 , 155 , 156 , 181 , 336 ]. 조직에서, 장력 하의 원 섬유 형 콜라겐 구조는 코일 구조로 부분적으로 전이된다. 단일 삼중 나선으로 구성된 용해성 콜라겐 분자는 단일 단백질 사슬로 분해되어 길이가 1/3 인 코일 구조를 채택합니다 [ 337 , 338]. 성장 된 조직에서, 섬유질 구조는 물리적 얽힘에 의한 섬유의 고정 및 화학적 가교가 삼중 나선이 수축 될 수있는만큼 수축된다. 이 변성 콜라겐은 효소 분해에 매우 민감하고 기계적 안정성이 감소한다. 방사능과거에는 γ-, β- 및 UV 방사선과 같은 다른 종류의 방사선이 연구되었다. UV 방사선은 물리적 가교 기술로 사용되며 가교 섹션에서보다 집중적으로 논의됩니다. γ- 및 β- 방사선은 의료 제품을 멸균하는 데 사용됩니다. 이것은 해당 섹션에서도 고려됩니다. 화학 처리화학적 처리는 조직으로부터 결합 된 이온, 탄수화물, 구형 단백질, 지질, 지방, 핵산 및 엔도톡신을 제거하는 것을 목표로한다. 이상적으로는 구조에 영향을 미치지 않고 순화 된 결합 조직 만 남습니다. 표 10 은 처리 될 조직의 잔류 물 및 불순물,이를 제거하기 위해 사용 된 화학 첨가제 및 반응 메커니즘을 요약한다. 콜라겐 구조에 대한 작용 및 효과는 아래에서보다 상세하게 논의된다. 산, 염기, pH 및 등전점 (IEP)측정 된 콜라겐 타입 I의 등전점 (IEP)은 7.8 [ 339 ]이지만, 시퀀스 (UniProt; 소 타입 I; P02453)로부터 9.2 (a1 (I)) 및 9.9 (a2 (I))의 IEP가 계산되었지만; ExPasy ProtParam 툴을 사용한 텔로 펩티드를 포함하는 3 중 헬리컬 부분의 P02465). 콜라겐 원료를 알칼리성으로 처리하면 IEP가 감소합니다. 젤라틴 타입 B가 제조 될 때 집중적 인 알칼리성 전처리가 특징적이며, 이는 글루타민 및 아스파라긴을 형성하기 위해 글루타민 및 아스파라긴의 부분 탈염을 초래한다. 5 이하의 IEP가 달성된다 [ 340 , 341 ]. 모든 Gln 및 Asn이 Glu 및 Asp와 교환되는 경우, ProtParam을 사용한 계산은 IEP 4.8 (α1 (I)) 및 IEP 4.9 (α2 (I))로 이어집니다. Collagenous 조직은 IEP에서 현저하게 벗어난 pH에서 수백 퍼센트 팽창 할 수 있습니다 (그림 17 ). 이 팽창은 Donnan의 잠재력과 조직에 주변 물이 유입되는 하전 된 단백질 사슬의 거부에 의해 설명되었다 [ 342 ]. 붓기는 콜라겐 처리와 관련하여 몇 가지 결과를 초래합니다. 콜라겐 분자는 안정화 된 주변 콜라겐 분자 [ 135 , 343 , 344 ] 로부터 분리 및 결합 해제 되고, 물질은 유리하고 부분적으로 투명한 것으로 보인다. 가용성 콜라겐이 추출되는 동안, 산성 pH는 최대 pH 3의 조직에서 가교 콜라겐의 높은 내부 장력을 생성합니다. 콜라겐 분자의 분리는 약 20 ℃만큼 변성 온도를 감소 시키며, 이는 조립 된 콜라겐과 분자 콜라겐 삼중 나선의 차이이다. 따라서, IEP에서 벗어난 pH에서 조직 내 콜라겐의 열 안정성은 가용성 콜라겐과 유사하지만, 여전히 자연적으로 가교되어 있기 때문에 가용성이 아니다. (가) T 증가 D를 도.에서 17 중성 pH 약 수용성 콜라겐은 측정시 세동 또는 침전의 결과이다. 저혈압 치료 및 고혈압 치료 – 소금의 영향이온은 전하, 농도 및 콜라겐 조직의 구조적 수준에 따라 콜라겐에 많은 영향을 미칩니다. 콜라겐을 처리하려면 다른 소금이 콜라겐 구조에 어떤 영향을 미치는지 아는 것이 가장 중요합니다. 일부 효과는 Hofmeister 시리즈로 설명 할 수 있지만 특히 다가 이온의 영향과 피 브릴 구조에 미치는 영향은 복잡합니다. NaCl 또는 인산 나트륨과 같은 중성 염의 등장 용액에 의해 조직으로부터 IEP에서 낮은 수율의 비가 교 콜라겐을 추출 할 수있다. 이러한 콜라겐은 인산 용액에 30 ~ 37 ° C에서 조립되었습니다 [ 66 ]. 농도는 20 밀리몰 / T의 증가에 이르게 L 이하에서 중성 조건 하에서 가의 음이온 약간 수용성 콜라겐 안정화 D . 이것은 충전 검사와 함께 설명됩니다. 20, 500 밀리몰 / L 사이, 다른 염은 약간 낮은 발생하거나 더 높은 T D는 Hofmeister 시리즈 이온의 위치 (H에 따라 2 PO 4 - SO> 4 2- > CL - > SCN -). 로다 니드가 T D를 감소시키는 동안 인산염은 안정화된다 . 500 밀리미터 / L 이상 농도를 더욱 증가 T 밝혀졌다 D [ 316 , 345 , 346 ]. 또한, 1가 염은 이러한 전하 스크리닝 효과에 의해 산성 pH에서 팽윤을 억제 할 수있다. 2 mol / L NaCl을 첨가하면 pH 3에서의 팽창 피크가 거의 완전히 사라지는 반면 알칼리성 팽창은 영향을받지 않습니다 [ 343 ]. 이 원리는 조직의 pH 의존성 장력을 방지하면서 가교를위한 피부 콜라겐을 제조하는데 널리 사용된다. DNA는 산성 pH에 의한 절단에 매우 민감하기 때문에 탈세 포화 동안 중요해진다. 조직에서는 여러 가지 효과가 IEP에 겹쳐집니다. 이온화에 의한 콜라겐 삼중 나선의 안정화 또는 불안정화는 염장 및 염장으로 해석되어 조립 된 콜라겐 소 섬유의 안정화 및 불안정화 효과와 경쟁한다. 상이한 구조적 성분은 T D 및 ΔH D의 평가에 의해 분리 될 수있다 . ΔH D 는 삼중 나선 안정성의 직접적인 측정 이지만 , T D 는 섬유소 안정성과 관련된 엔트로피 부분도 반영합니다. 따라서, 상이한 구조적 수준의 콜라겐에 대한 이온 효과를 분리 할 수있다. 자신의 결과 (도. 18 , 19 ) [ 347 ] T에 다른 염 영향 표시 D 및 ΔH D 탈모 감추기 돼지 콜라겐한다. 화학 모발 제거 후, 조직을 중성으로 조정하고, 상이한 농도의 이온에 담그고 열량 측정 하였다. 음이온 H 2 PO 4 - 및 SO 4 2- 상당히 콜라겐 원 섬유를 안정화. 0.5 몰 / L 사이, 2 몰 / LT D는 ΔH 동안 20 ° C로 선형 증가 D가 크게 영향을받지 않고 남아있다. 대조적으로, 염화칼슘은 삼중 나선 구조뿐만 아니라 원 섬유를 불안정화시킨다. 왜냐하면 T DΔH가 감소하고 있습니다. Lim et al.에 의해서도 유사한 결과가 발견되었다. 소 아킬레스 건이있는 [ 348 ]. 그림 18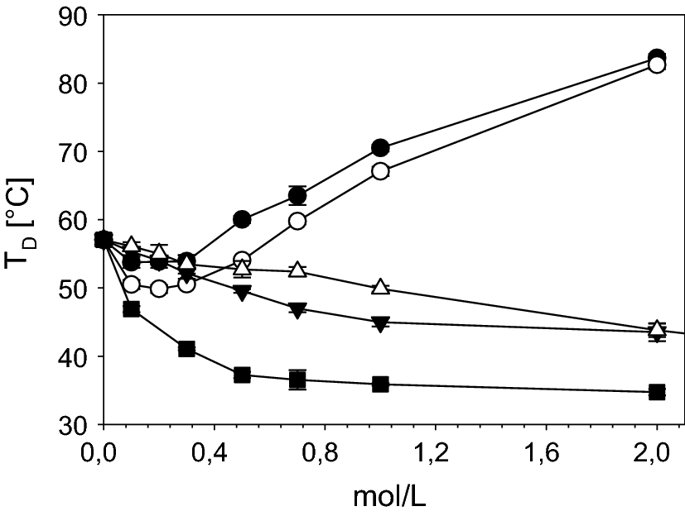 상이한 첨가제 농도 및 상이한 종류의 첨가제에 따른 돼지 가죽의 변성 온도 (T D ); 채워진 원 : 인산 칼륨; 개방 원 : 암모늄 설페이트; 아래쪽을 향한 채워진 삼각형 : 트리스 -HCl pH7; 열린 삼각형을 위로 : 요소; 채워진 사각형 : 염화칼슘 [ 347 ] 그림 19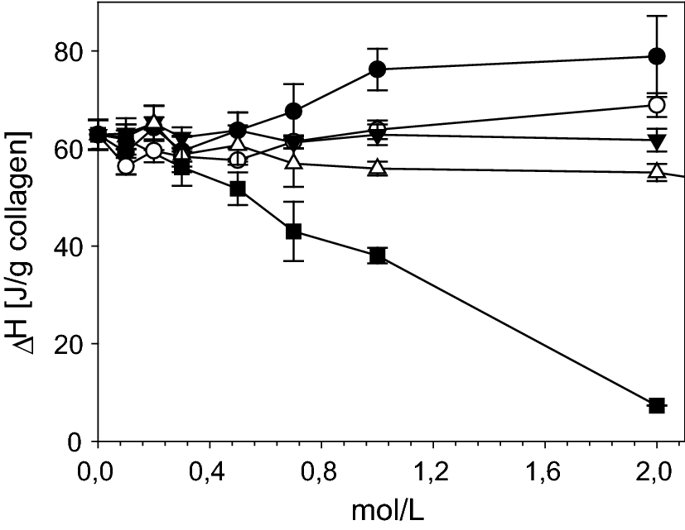 상이한 첨가제 농도 및 상이한 종류의 첨가제에 따른 돼지 가죽의 변성 온도 (T D ); 채워진 원 : 인산 칼륨; 개방 원 : 암모늄 설페이트; 아래쪽을 향한 채워진 삼각형 : 트리스 -HCl pH7; 열린 삼각형을 위로 : 요소; 채워진 사각형 : 염화칼슘 [ 347 ] 희석 된 염산 (TrisHCl)으로 완충 된 최대 2 mol / L 우레아 및 트리스 (하이드 록시 메틸)-아미노 메탄은 다른 이온과 다르게 행동한다. 이 농도에서 모두는 T의 감소로 이어지는 조립 섬유의 구조에 영향을 D를 하지만, ΔH에 영향을주지 않는 D를 . 삼중 나선 구조는 영향을받지 않지만, 섬유질 구조는 중성 pH에서 부분적으로 불안정화됩니다. 이것은 pH 중성 세포 배양 호환 습식 콜라겐 제제를 생산할 때 중요한 특성입니다. 유기 용제에탄올, 메탄올, 아세톤 및 트리 부틸 포스페이트는 세포 성분, 지방, 지질 및 내 독소를 제거하는 데 일반적으로 사용되는 유기 용매입니다. 글리세롤, 에틸렌 글리콜 및 폴리에틸렌 글리콜은 가습 제 및 콜라겐 물질의 가소제로서 사용된다. 용매는 콜라겐 분자 주변의 물 껍질에 영향을 미칩니다. 단순 알코올의 첨가는 조직에서 변성 온도를 증가시킬뿐만 아니라 팽창을 일으키지 않으며, 해결 된 콜라겐이 침전된다 [ 349 ]. 다가 알코올의 사용은 콜라겐을 열에 대해 추가로 안정화 하지만 [ 350 , 351 , 352 ], KCl의 존재 하에서 부작용이 관찰된다 [ 353 ]. 유기 가연성 용매를 사용하면 가공과 관련하여 몇 가지 단점이 발생합니다. 그것들은 완전히 제거되어야하고, 방화 요건에 따라 설비를 건설해야하며, 동결 건조에 의해 용매를 제거하는 것은 쉽지 않습니다. 따라서, 용매의 사용을 회피하려고 노력하고 수계 시스템이 일반적으로 사용된다. 특히 컴팩트 한 물질과의 일부 가교 반응의 경우, 용매 및 유기 용매가 사용되어야하기 때문에 수성 완충제를 피하는 것이 유리하다 [ 265 , 354 , 355 , 356 ]. 예를 들어 헥사 메틸 디 이소시아네이트 (HMDI)는 건조 된 아세톤 또는 2- 프로판올에 적용되고, EDC는 일반적으로 에탄올에 용해된다. 그렇지 않으면, 폴리 우레아 (HMDI) 또는 가수 분해 (EDC)의 형성으로서의 부반응이 우세 할 수있다. 세제세제는 주로 지방과 지질을 제거하는 데 사용됩니다. 소듐 도데 실 설페이트 (SDS) 또는 소듐 도데 실 벤젠 (SDB) 및 다른 것들이 종종 음이온 성 세제로 사용된다 [ 22 , 123 , 357 , 358 , 359 ]. 비이 온성 세제는 일반적으로 Triton X 시리즈에 속합니다. 세제는 GAG, 성장 인자 및 비 콜라 게 노스 단백질뿐만 아니라 소수성 물질을 방출 할뿐만 아니라 콜라겐 매트릭스에도 흡착됩니다 [ 358 , 360]. 경우에 따라 구조가 팽창 할 수 있지만 변성은 직접 발생하지 않습니다. 최근의 조사에 따르면 집중 세척 후에도 계면 활성제의 잔존물과 다른 물질이 탈세 포화 된 조직에서 발견되는 것으로 나타났습니다 [ 172 ]. 세제의 잔존물이 세포 독성 효과를 일으키는 것으로 논의 되었기 때문에, 최근의 기술은 그 사용을 피하는 것을 목표로한다 [ 361 , 362 , 363 ] 킬레이트 제킬레이트 제는 칼슘, 철, 코발트 등과 같은 다가 금속 이온에 결합합니다. 예를 들어 뼈의 전형적인 석회 제거 기술은 미네랄 성분을 제거하기 위해 예를 들어 에틸렌 아미노 테트라 아세테이트 (EDTA)로 샘플을 집중적으로 처리하는 것을 포함합니다 [ 364 , 365 ]. EDTA는 탈세 포화 과정에서 작용 제로도 사용됩니다. 정확한 영향은 불분명하지만 [ 20]. 콜라겐은 다가 양이온과도 결합하며 킬레이트 제는 이러한 이온의 콜라겐과 경쟁합니다. 콜라겐은 복잡한 결합의 형성에 의해 철, 알루미늄 또는 크롬 (Catgut)으로 안정화됩니다. EDTA에 의해이 이온들은 완전히 제거 될 수 있습니다. 따라서, EDTA의 킬레이트 능력은 콜라겐의 킬레이트 능력보다 높다. 킬레이트 화제도 콜라겐 구조 나 아미노산 조성 [영향 366 ]이지만 인해 철 함유 prolylhydroxylases 의해 시험관 내에서 새로운 콜라겐을 히드 록되어야 생체 내에서 세포에 의한 콜라겐의 형성시에, 완전히 제거되어야 할 2 + 중심 이온으로서 [ 367 ]. 이러한 가수 분해 효소의 작용은 킬레이트 제에 의해 방해됩니다. 환원 처리1 세기 이상 동안 환원제는 케라틴을 용해시킬 수있는 것으로 알려져있다 [ 368 ]. 환원제는 콜라겐 구조에 영향을주지 않으면 서 돼지, 소 또는 말 피부에서 모발을 제거합니다. 오늘날, 일반적으로 황화 나트륨이 환원제로 사용되지만 티오 글리콜 산도 가능하다. 환원제는 시스틴의 황 이중 결합을 시스테인으로 절단하고 케라틴 구조가 불안정화된다. 환원 단계는 주쇄를 절단하고 케라틴이 용해되는 알칼리 처리와 결합된다. 보다 최근의 자체 연구에 따르면 알칼리성 처리와 단백질 분해 효소 및 호모시스테인의 조합은 콜라겐 매트릭스에 영향을주지 않으면 서 케라틴을 용해시킬 수 있습니다 [ 369 ]. 특히 콜라겐에 대한 화학적 또는 구조적 영향을 조사하기 위해 추가의 환원제를 사용하는 것은 분석적 접근법으로 제한된다 [ 87 , 370 , 371 ]. 산화 치료기술적 인 과정에서, 콜라겐 기반 조직은 종종 산화제, 특히 과산화수소,과 아세트산 (PAA) 및 차아 염소산 나트륨으로 처리됩니다. 메티오닌은 메티오닌 술폭 시드 또는 메티오닌 술폰으로 옮겨지고, 차아 염소산염은 탈염을 유발할 수 있으며, 디 티로신의 생성에 의해 가교가 일어날 수있다 [ 372 , 373 ]. 과산화수소는 다른 단백질의 Met의 산화를 관찰하지 않은 다른 관찰과 비교하여 분리 된 콜라겐 결합 Met ( 실온에서 밤새 1 % H 2 O 2 ; 미공개) 를 산화시키는 자체 시험에서 관찰되었다 [ 372 ]. 콜라겐의 디 티로신은 티로시나 아제와 과산화수소의 존재 하에서 만 형성되는 것으로 밝혀졌다 [ 374 , 375 ]. 콜라겐 처리 기술 및 후속 물질 분석과 관련하여, 콜라겐에서 Met의 술폭 사이드로의 산화는 두 가지 결과를 초래한다. 첫째, Met에서 콜라겐을 절단하고 정확한 분자량을 가진 적은 수의 펩타이드를 생성하는 BrCN으로 일반적으로 사용되는 처리는 더 이상 작동하지 않습니다. 펩타이드의 BrCN- 절단 및 분리는 콜라겐 유형을 구별하기위한 중요한 기술 중 하나이다 [ 376 , 377 , 378 , 379 ]. 따라서,이 분석 기술은 산화 처리 된 콜라겐의 결과로 이어지지 않습니다. 둘째, Met는 콜라겐 구조에서 효율적인 산화 마커로 사용될 수 있습니다. 만약 콜라겐 물질이과 아세트산에 의해 살균된다면 아미노산 분석을 통한 Met의 감소로 효과적인 치료를 증명할 수 있습니다. 피부 콜라겐에서 Met의 수는 1 시간 처리 후 8에서 2 또는 3으로 감소하는 것으로 밝혀졌다. 효소1 세기 전에 Röhm [ 380 ]은 피부에서 비 콜라 게 노스 단백질을 제거하기 위해 산업적으로 생산 된 췌장 프로테아제의 사용을 발명했습니다. 오늘날, 프로테아제의 사용이 가장 중요하지만, 구체적으로 또는 광범위하게 작용하는 프로테아제, DNA 분해 효소, 리파제 및 탄수화물과 같은 다양한 분해 효소의 사용이 확립되고있다. 일부 적용에서, 효소는 또한 가교제로서 적용될 수있다. 프로테아제콜라겐의 삼중 나선 구조는 효소 분해에 대해 매우 안정적입니다. 생체 내 콜라겐은 결합 조직 단백질을 특이 적으로 대사하는 엔도 펩 티다 제 그룹 인 매트릭스 메탈로 프로 테이나 제 (MMP)에 의해 거의 독점적으로 소화된다 [ 381 ]. 뼈와 연골에서 콜라겐은 또한 카 텝신 K에 의해 절단 될 수있다 [ 382 ]. 척추 MMP는 삼중 나선 콜라겐 타입 I을 Gly 775와 Ile 776 사이의 정확히 한 위치에서 1/4에서 3/4로 나눕니다 [ 322 ]. 대부분의 MMP는 절단 부위를 인식하고 콜라겐 삼중 나선을 풀 수있는 페신 부분과 콜라겐 주쇄를 절단하는 촉매 부분으로 구성된다. 따라서, MMP는 생체 내에서 콜라겐 회전율의 취약한 평형을 담당한다 [ 383 ,384 , 385 , 386 ]. Dispase는 주로 피브로넥틴과 콜라겐 IV에 영향을 미치고 콜라겐 I에만 영향을 미치는 특수 박테리아 콜라게나 제입니다. 기질에서 온전한 상피 시트와 표피를 제거하는 데 사용되어 왔지만 [ 387 ] 돼지 진피를 효과적으로 탈세 포화하기 위해 모든 세포 성분을 제거한다 [ 388 ]. 대조적으로, 비 콜라겐 특이 적 프로테아제는 콜라겐 사슬의 비 나선 부분 (텔로 펩티드)에만 영향을 미쳐 분리 된 삼중 나선 분자를 초래한다 [ 389 ]. 가용성 콜라겐을 제조 할 때 수율을 높이기 위해 기술적으로 사용됩니다. 어린 동물의 콜라겐은 주로 telopeptide 지역에서 가교됩니다. 따라서, 텔로 펩타이드의 절단은 용해도를 증가시킨다. 콜라겐 타입 III의 삼중 나선 부분 만이보다 특이적인 세린 프로테아제에 의해 영향을 받는다. 효소의 잔류 물이 정제 된 물질에 남아 있다는 것을 배제 할 수 없기 때문에, 콜라겐 기반 바이오 물질 및 탈세 포화 기술을 준비 할 때 효소의 사용을 최소한으로 줄여야한다 [ 362 ]. 그럼에도 불구하고 많은 기술 프로토콜은 프로세스에서 효소 단계를 사용합니다. 그런 다음 처리 효소가 완전히 제거되었음을 적절한 기술 (예 : ELISA)로 확인해야합니다. 다른 분해 효소탄수화물, 프로테오글리칸, 핵산 및 일부 지질과 같은 비 단백질 성분을 구체적으로 가수 분해하는 다른 효소가 논의되었다. 리파제 트리글리세리드 및 cholesterolesters 및 해당 지방산이지만 용매 및 계면 활성제의 쪼개짐 에스테르 결합은 지용성 성분 [제거하는 것이 더 효과적이다 (20) , 390 ]. 탈세 포화에서 프로테아제 옆에 사용되는 가장 중요한 효소 그룹은 RNA 및 DNA의 세포 잔존물을 제거하는 뉴 클레아 제이다 [ 390 , 391 , 392 , 393 , 394 , 395 , 396 , 397 , 398 ]. DNA 잔재는 많은 최종 제품에서 발견되었지만 [ 314 , 399 ] DNA 자체가 부작용을 유발하는지 또는 DNA가 세포 잔재에 대한 마커로서 만 작용하는지는 확실하지 않다 [ 400 ]. 자체 시험에서 특히 산 (<pH2)이 효과적으로 DNA를 공격하지만 흡착 된 DNA가 열화에 대해 훨씬 더 안정적이라는 것이 밝혀졌다 [ 401]. 뉴 클레아 제가없는 프로토콜이 이용 가능하여 DNA 수준이 충분히 낮기 때문에 뉴 클레아 제의 사용이 필요하지 않은 것 같습니다 [ 390 , 393 ]. 성공적인 탈세 포화를위한 순도 마커로서 Crapo et al. [ 20 ]은 충분한 탈세 포화를위한 지표로서 DAPI와 헤 마톡 실린 및 에오신 염색 후 200 bp 이하의 길이와 가시 핵이없는 최대 50 ppm DNA를 제안했다. 트랜스 글루 타미 나아 제단백질 결합 글루타민과 ε- (γ-glutamyl) lysine isopeptides로 이어지는 리신의 ε- 아미노기 사이의 아 실기의 이동을 촉매하는 효소를 트랜스 글루 타미 나나 (Tgase)라고한다 [ 402 ]. 따라서, Tgas는 단백질을 가교 결합하고 생물학적 접착제로서 작용할 수있다. 그것들은 미생물에서 포유류와 식물에 이르기까지 애니메이션 세계에 널리 퍼져있다 [ 403 ]. Tgases는 또한 콜라겐과 변성 콜라겐 (젤라틴)을 안정화시키는 데 사용되었습니다. 이는 돼지 된 TGase T 약간 증가 할 수 있었던 것을 알 수 있었다 D를 [삼중 나선 가교 대한 주장 66 ° C까지 콜라겐 404]. 포유 동물 Tgase와 달리, 미생물 변이체는 삼중 나선 콜라겐을 안정화시킬 수 없었지만 변성 된 형태의 젤라틴만을 안정화시킬 수 있었다. 반응은 삼중 나선의 변성 정도에 직접적으로 의존한다는 것이 밝혀졌다. Tgase는 콜라겐 매트릭스에 집중적으로 흡수되며 과량의 물로 4 번 씻음에도 불구하고 Tgase의 절반이 여전히 재료에 남아 있음을 보여 주었다 [ 405 , 406 ]. 내 독소 제거내 독소는 그람 음성 박테리아의 외부 세포막의 리포 폴리 사카 라이드이다. 이들은 세포막 기반 지질에 연결된 올리고당과 항원 부분 (O-antigen)을 나타내는 매우 다양한 다당류 사슬로 구성된 핵심 영역으로 구성됩니다. 내 독소는 또한 박테리아가 사망 한 후 해방되며, 180 ° C까지의 열, 용매 및 기타 많은 화학 물질에 대해 안정적이기 때문에 제거가 어려워진다. 피부, 힘줄, 내장 및 기타 조직과 같은 생체 재료를 제조하기위한 원료는 이미 소싱에 의해 오염되어 있으며, 용기, 튜브, 펌프 및 화학 물질은 내 독소를 포함 할 수 있지만 오염의 가장 중요한 원인은 실험실 용수입니다 [ 178 ]. 열에 민감한 생물학적 물질로부터 내 독소 함량을 제거하기 위해, 강산 (1N HCl), 알칼리성 (1N NaOH) 및 에탄올 70 %로 처리하면 오염이 충분히 감소 될 수 있음이 밝혀졌습니다 [ 178 , 407 ]. 불용성 콜라겐 물질에 대한 자체 시험은 분석조차도 정확한 시료 준비에 달려 있으며 시험 전에 물질을 정확하게 분해해야한다는 것을 보여주었습니다. 내 독소를 제거하기 위해, 차가운 상태에서 과도한 pH 변화 (pH 2; pH 14)를 번갈아 사용하고 과산화수소를 성공적으로 적용했습니다 [ 179 , 180 ]. 특수한 경우 — 합성 가교합성 가교는 재 조립 및 자연 가교에 의해 달성되는 안정성을 넘어서서 습윤 상태에서 온도, 효소 분해 및 기계적 부하에 대해 콜라겐을 안정화시킨다. 가교 방법에 관한 문헌은 가죽을 화학적으로 안정화 된 콜라겐 물질로 만드는 오랜 전통 때문에 포괄적이다. 생체 재료를 안정화시키기 위해, 화학적 및 물리적으로 가교가 달성 될 수있다 (검토를 위해 [ 408 ] 참조 ). 화학 가교화학 물질은 기술, 의료 및 제약 분야에서 콜라겐을 안정화시키는 데 사용됩니다. 콜라겐 아미노산의 측쇄는 많은 다른 화학 반응을 허용합니다. 과거에 의약 제품에도 사용되었던 다가 양이온을 사용하는 방법, 예를 들어 크롬 이온에 의한 catgut의 안정화는 더 이상의 생명 응용과 관련이 없기 때문에 고려되지 않을 것입니다. 다른 작용제는 이작 용성 알데히드, 이소시아네이트, 카르 보디이 미드 및 아실 락 시드, 에폭시 드 및 식물 부분으로부터 추출 된 일부 천연 작용제이다. 습한 조건 에서 3 중 나선이 저장 될 때 온도가 T D를 초과해서는 안됩니다 . 이를 위해서는 60 ° C 미만의 온도에서 주변 환경이 필요합니다. 용매의 사용은 기술적으로 더 비싸고 추가적인 안전 측면을 따라야하며 과도한 건조로 인한 영향에 대해 논의해야합니다. 그러나, 용매를 사용하면보다 높은 가공 온도를 사용할 수 있고, 모세관 력에 의해 다공성 구조 (스펀지)가 붕괴되는 것을 방지 할 수있다. 알데하이드1 차 알데히드는 리신의 ε- 아미노기와 반응한다. 가장 흔한 것은 포름 알데히드와 글루 타르 알데히드이지만, 둘 다 다르게 반응하고 여러 반응 채널이 논의된다 [ 409 , 410 ]. 포름 알데히드의 반응은 기체상에서 또는 중성 조건 하에서 희석 된 용액에 담그면 쉽게 달성 될 수있다. 반응은 가역적이고, 포름 알데히드는 예를 들어 가열에 의해 처리 된 물질로부터 다시 유리된다. 그럼에도 불구하고, 지혈제로서 수술에 사용되는 젤라틴 스펀지는 이러한 방식으로 안정화된다. 글루 타르 알데히드와의 가교는 현저하게 증가 된 T D 및 효소 분해에 대한 높은 안정성을 초래 한다. 재료는 대부분 용액에 담가서 처리하지만,상에서 성공적인 가스상 처리가 가능합니다. 복잡한 구조가되기 위해 추가로 반응하는 중간체와 함께 2 개의 상이한 반응 채널이 논의되었으며, 이는 Damink et al. [ 249 ]. 결국, 평균적으로 각각의 아미노기는 3 개의 글루 타르 알데히드 분자와 반응한다. 과거에, 생체 물질을 안정화시키기 위해 글루 타르 알데히드의 사용이 집중적으로 논의되었다. 알데히드는 분해 동안 다시 유리 될 수 있으며 독성 효과를 일으킬 수있다 [ 411 , 412], 글루 타르 알데히드와의 가교 는 정확한 메커니즘이 명확하지 않지만 석회화를 시작한다 [ 413 , 414 , 415 ]. Zilla et al. [ 416 ]은 매우 높은 농도의 글루 타르 알데히드가 석회화를 방지 할 수 있음을 발견했다. 다른 사람들은 심장 판막 전단지를 준비하기 위해 글리신으로 글루 타르 알데히드 가교 심낭을 처리하면 석회화가 방지됨을 보여 주었다 [ 417 ]. 다른 이작 용성 알데히드는 콜라겐, 예를 들어 아크롤레인, 글리 옥살, 말론 디 알데히드, 숙신 알데히드 및 디 알데히드 전분을 안정화시킬 수있다 [ 410]. 그것들은 또한 다른 위험을 야기하며 정확한 반응 메커니즘은 잘 알려져 있지 않습니다. 따라서, 대안적인 가교제에 대한 집중적 인 검색이 지난 몇 년 동안 수행되었다. 이소시아네이트콜라겐은 또한 헥사 메틸렌 디 이소시아네이트 (HMDI)가 가장 흔한 이작 용성 이소시아네이트와 가교 될 수있다. HMDI는 실온에서 ε- 아미노기와 반응한다. 물에는 거의 녹지 않으며 계면 활성제를 사용하여 유화해야합니다 [ 247 ]. 중성 및 높은 pH에서 반응은 산성 pH에서보다 빠릅니다. 반응이 물에서 수행되면, 고 불용성 폴리 우레아가 부산물로서 형성된다. 따라서, 이러한 피부 (Permacol 두꺼워 조직 콜라겐 가교 ® 의 반응에 앞서 조직에 적합한 HMDI의 확산이 필요), 보통 용매 예컨대, 2- 프로판올, 아세톤 [행한다 354]. 수성 시스템 또는 DMSO를 사용하여 여전히 반응성 이소시아네이트기를 갖는 폴리 우레탄 예비 중합체에 의해 심낭을 안정화 시켰다 [ 354 , 418 ]. 카 보디이 미드 및 아실 라지 드카르 보디이 미드 및 아실 라지 드는 콜라겐의 카르 복실 산기와 반응한다. 가장 일반적으로 사용되는 카르 보디이 미드 에틸 -3 (3- 디메틸 아미노) 프로필 카르 보디이 미드 (EDC)는 카르 복실 산 측쇄와 함께 O- 아실 우레아기를 형성 한 다음, ε- 아미노기와 반응하여 이소 펩티드 결합을 형성한다. 이 새로운 펩티드 그룹 이외에는, 새로운 결합 또는 그룹이 포함되지 않으며, 이는 글루 타르 알데히드와 논의 된 바와 같이 부정적인 효과를 회피한다. 상기 반응은 O- 아실 우레아와 반응하여 활성화 된 NHS 에스테르가 되는 N- 하이드 록시 숙신이 미드 (NHS)에 의해 실시된다 . 이들은 아민 기와의 반응 확률이 증가하는 활성화 된 카르복실기를 나타낸다. EDC와 함께 NHS로 치료 양 피부 샘플 T의 증가 보였다 D를이 활성화가없는 시료와 비교하여 10K 및 1/3 이상의 형질 전환 된 NH 기 [ 248 ]. Petite et al. [ 419 ]의 메틸화에 의해 acylazides 카르복실기, 히드라진 전송 및 수성 염수 용액에 아질산 마지막 반응을 활성화. 활성화 된 카르복실기는 ε- 아미노기와 반응하여 이소 펩티드를 형성한다. 그러나 특히 첫 단계로서의 에스테르 화는 7 일 지속되었다. 에폭시 드1,4- 부탄디올 디 글리시 딜 에테르 (BDDGE) 또는 에틸렌 글리콜 디 글리시 딜 에테르 (EGDGE)와 같은 이작 용성 에폭 사이드는 중성 또는 알칼리성 pH에서 다른 콜라겐 분자의 ε- 아미노기를 가교시킨다 [ 420 , 421 ]. 동 역학적 조사에 따르면 염기성 및 산성 촉매가 각각 가능하지만 알칼리성 조건에서는 반응이 더 빠르며 조직이 더 단단해집니다. 성 등. [ 420 ] T 달성 D 24 시간의 반응 시간 후, pH를 10.4에서 4 % 용액 EGDGE 돼지 힘줄에 78 ° C의이. 낮은 온도, pH 및 가교제의 농도가 낮은 최종 의한 T D를 . Zeeman et al. [ 421 ] 처리 양 피부 7 일 이상 수성 완충액에서 주위 온도에서 BDDGE와 콜라겐과 산성 조건 하에서 카르복실기 가교 달성했다. 이어서, 이들은 T 가교 재료 달성 NHS / EDC로 유리 아민 그룹을 변환 D 효소 분해에 대해 높은 안정성을 80 ℃로한다. 자연 유래 가교제천연 가교제는 가죽 제조에 오랫동안 사용되어왔다. 과거에는 갈산과 포도당 부분의 에스테르 인 가수 분해성 탄닌과 카테 콜 단위의 중합체 인 축합 형 탄닌으로 나 were습니다. 두 그룹 모두 잎, 목재, 갈기, 나무 껍질 또는 다른 식물 부분에서 추출한 전형적인 유제를 포함합니다 (조사는 [ 194 ] 참조 ). 바이오 의학 응용을 위해 콜라겐을 안정화시키는 것은 일반적이지 않지만, 많은 사람들이 오랫동안 제약으로 사용되어왔다 [ 422 , 423 , 424 ]. 바이오 물질을 안정화시키는 두 가지 식물 기반 시약 그룹이 점점 더 흥미로워졌습니다. 제 1 기는 콜라겐의 유리 아미노기와 친 핵성 첨가에 의해 반응하는 퀴논을 포함한다. 이것은 또한 byssus를 기질에 달라 붙는 홍합 접착제의 원리입니다. 분비선은 o- 퀴논으로 효소 적으로 산화 된 DOPA를 생성 한 다음, 이민 형성 또는 마이클 첨가에 의해 단백질을 가교 결합하여 몇 가지 가능한 반응 중 두 가지만을 언급 할 수있다 [ 425 , 426 , 427]. 산화 효소 (티로시나제, 락카 제)를 직접 사용하여 텔로 펩티드에서 발견되는 콜라겐의 티로신을 활성화시켰다. 티로시나제-촉매 된 도파 치논은 다른 아미노기와 직접 반응합니다. Laccase는 dityrosine으로 이량 체화되는 티로신 라디칼을 유발한다 [ 375 ]. 노르 디 하이드로 구아 레트 산 (NDGA)은 콜라겐을 안정화시키기 위해 조사 된 크레오소트 덤불로부터 생성 된 에스테 콜이다. Koob et al. NDGA가 콜라겐보다 콜라겐 섬유를 둘러싸는 매트릭스로 중합된다고 가정하고 직접적으로 가교된다 [ 428 , 429 ]. 식물-기재 가교제의 다른 그룹은 선택된 이리도 이드 및 secoiridoid의 화합물을 포함한다. 이러한 식물성 화학 물질은 많은 식물 군에 의해 생산되며 수천 가지 변형이 설명되어 있으며 특징이있다 [ 430 , 431 , 432 , 433 ]. 두 명의 대표자는 지니 핀과 올 유럽인입니다. 지니 핀으로 콜라겐을 치료하면 진한 파란색이됩니다. 반응 메커니즘은 완전히 명확하지 않지만 콜라겐의 ε- 아미노 그룹이 소비된다 [ 434 , 435 , 436 ]. Oleuropein은 과거에 가교 활동을 조사한 두 번째 예입니다. 탈글 라이코 실화 된 본 secoiridoid로 콜라겐을 처리하여 (0.2 % 용액, pH가 7, 25 ℃, 0.5 U / mL의 β 글루코시다 아제) T D를 20 K만큼 증가하고 ε 아미노 그룹의 수는 감소한다. 정확한 반응 메커니즘은 명확하지 않지만, 반응의 동역학 및 반응 생성물의 안정성은 글루 타르 알데히드와 유사하다 [ 194 , 437 , 438 ]. 물리적 가교콜라겐은 다른 물리 치료에 의해 가교 될 수 있습니다. 가장 중요한 것은 조사 (UV, γ, β) 및 탈수 열 처리 (DHT)입니다. 그러나, 각각의 물리적 처리는 또한 한번에 사슬 가위를 야기하며, 효과가 바람직하게 발생하는 조건에 의존한다 [ 439 , 440 ]. 조사가 실시되면, 샘플이 젖었을 때 가교가 더 강하게 관찰되고, 용해도 감소로 측정되며, 건조 상태에서는 사슬 가위가 더 자주 발생한다 [ 439 ]. 보렐 Monboisse 및 [ 441 ] γ- 및 β- 조사 리드 중 산소의 존재는 수퍼 옥사이드 라디칼을하는 것으로 (O 2 - )가 원인 체인 scissions로 가정한다. 산소가 없으면, 히드 록실 라디칼 (OH ·)이 형성되어 가용성 콜라겐을 중합시킨다. 정확한 반응 메카니즘은 공지되어 있지 않으며, 가교 및 절단에 대해서도 알려져 있지 않다. 공학적 관점에서, 어떤 반응이 바람직한지를 제어하는 것은 매우 어렵고, 이는 또한 멸균 방법에 관한 결과를 초래한다. 탈수 열 처리 및 건조는 동일한 공정의 두 단계입니다. 조직에서, 콜라겐이 수용액 또는 수성 시스템에서 섬유소로서 제조 될 때, 물은 콜라겐 분자를 덮고 그것들이 수렴되는 것을 차단한다. 건조함으로써, 분자가 가까워지고 새로운 결합이 형성된다. 이들은 이온 성 및 소수성 상호 작용뿐만 아니라 예를 들어 알라닌과 리신 사이에 형성 될 수있는 공유 결합을 포함한다. 탈수 열 처리는 변성을 방지하기 위해 낮은 습도에서 강제 온도 처리 (110 ° C)입니다. 물에 대한 용해도는 감소하지만 효소 분해에 대한 안정성도 감소합니다. 따라서, 콜라겐의 일부 부분의 변성을 방지 할 수 없다 [ 440 , 442 ]. DHT는 젤라틴을 강화시키는 데에도 사용됩니다 [ 443 ]. 건조많은 콜라겐 기반 생체 재료는 건조한 상태로 판매됩니다. 그러나 건조는 결과 재료의 구조에 큰 영향을 미칩니다. , 솔루션 - suspension- 또는 조직 유래 여부 콜라겐 제제의 높은 팽윤 구조 때문에 모세관, T의 동작의 수분 제거 수렴 과정 D의 증가, 새로운 결합을 형성 할 수있는 정도. 그러나 건조는 콜라겐 물질의 형태를 안정화시킵니다. 정의 된 크기와 모양의 기공을 생성하는 데 사용될 수 있으며 사용하기 전에 보관 수명을 연장시킵니다. 또한, 콜라겐 물질을 살균하는 대부분의 절차는 물질이 건조한 경우에만 적용 할 수 있습니다. 대류 건조대류 건조를 통해 콜라겐 섬유와 분자가 완전히 붕괴되고 거리가 거의 최소로 줄어 듭니다. 단지 물 분자는 건조 상태 [에도 콜라겐 구조에 결합 된 상태를 유지 (156) , 444 ]. 그럼에도 불구하고, 섬유는 응집되고 콜라겐 분자 사이의 공유 반응이 일어난다. 이러한 필름의 재수 화는 어느 정도 재 팽창을 허용하지만 종종 건조 전에 초기 상태가 아니다. 필름은 대류 건조에 의해 제조됩니다. 유동성 산성 콜라겐 현탁액 또는 용액을 몰드에 캐스트하고 평형 습도에 도달 할 때까지 변성 온도보다 낮은 온도에서 진공하에 때때로 건조시킨다. 일반적으로 대류 건조 된 필름은 재료 습도가 8 ~ 15 %입니다. 대안 적으로, 콜라겐 현탁액은 냉각 된 평평한 다이를 통해 차가운 덩어리로서 압출되고 진공의 적용없이 연속적으로 건조 될 수있다. 결과로 생기는 모든 소형 필름은 반투명하게 보입니다. 용제 및 동결 건조용매 및 동결 건조는 각각 모세관 작용과 섬유 구조의 붕괴를 방지하기 위해 적용됩니다. 용매 건조 동안, 물을 증가하는 농도의 알코올 또는 아세톤에 침지시켜 물을 교환한다 (임계점 건조). 이것은 조직 학적 제제를 제조하기위한 확립 된 기술이지만, 생산 규모에 대한이 절차의 단점은 용매의 높은 소비이다. 이들은 많은 양을 취급 할 때 특별한 안전 예방 조치가 필요한 가연성 액체입니다. 또는 초 임계 이산화탄소 (CO)sc2)가 사용되었지만 COsc2 물과의 혼 화성이 낮고 CO의 처리량이 높음sc2 필요합니다 (게시되지 않은 결과를 소유하십시오). 동결 건조는 모세관 력을 감소시킵니다. 수성 콜라겐 제제로부터 물을 제거하고 다공성 구조를 생성하는 것이 일반적인 기술이다. 콜라겐은 -15 내지 -80 ℃의 적절한 온도 구배에서 동결되고, 모세관 력은 얼음 결정의 형성에 의해 억제된다. 진공 상태에서 얼음을 승화시킴으로써 물이 제거된다. 최종 다공성 구조는 동결 상태의 빙정의 구조에 관한 것이다. 이 기술은 규정 된 크기의 기공을 제조 할 수있게한다. 저온까지 가파른 냉각 구배를 적용하면 작은 구멍이 생깁니다. 더 큰 기공은 편평한 냉각 구배에 의해 달성된다 [ 445 , 446 , 447 , 448]. 작은 크기의 정렬 된 기공 및 튜브형 채널은 극성 온도 구배에 의해 달성 될 수있다 [ 263 , 448 , 449 ]. 동결 건조는 상처 치료 및 치과에서 지혈 적용을위한 평평한 또는 원통형 적용으로서 스폰지를 제조하는데 사용된다. 용매 또는 동결 건조없이 다공성 콜라겐-젤라틴 층을 제조하기 위해, 젤라틴 용액을 발포체로 휘저었고, 섬유질 콜라겐 현탁액을 젤라틴 발포체와 동일한 부분으로 조심스럽게 혼합하고,지지 기재에 적용하고, 젤라틴을 냉각에 의해 고화시켰다 . 이 기술을 통해 다공성 구조물을 빠르고 지속적으로 제조 할 수있었습니다 [ 221 ]. 살균클리닉 또는 세포 배양에 사용되는 각 콜라겐 물질에는 모든 형태의 생명체 또는 전염성 성분이 없어야합니다. 사용 된 오염 제거 기술은 준비 단계와 사전에 가능한 오염에 따라 다릅니다. 공정이 끝날 때 최종 포장재에 멸균 절차를 적용하지 않은 경우, 멸균 절차 다음 단계는 무균 조건에서 수행해야합니다. 여과법여과는 마이크로 필터를 통해 가압 될 수있는 액체 또는 기체 물질에만 사용할 수 있습니다. 산성 콜라겐 용액은 0.45 또는 0.2 µ 필터를 통해 저농도 (0.1–0.2 %)로 여과됩니다. 이 공정은 완만하지만 시간 소모적이며, 최종 제품이 건조 상태로 적용될 경우 건조로 많은 액체를 제거해야합니다. 이어서, pH를 중성으로 조정하고, 침전물을 무균 적으로 원심 분리하고 동결 건조시켰다 ( 210 ). 에탄올고체 실험실 샘플은 종종 물질을 오염 제거하기 위해 시험관 내 세포 배양 전에 물-에탄올 혼합물 (30 : 70 %)로 처리됩니다. 그러나 당국이 승인 한 멸균 기술은 아닙니다. 박테리아 및 곰팡이 포자 및 엔도톡신의 투명성은이 기술에 의해 달성 될 수 없으며, 콜라겐 바이오 물질이 시판 될 때 다른 방법이 적용되어야한다. 감마선 조사 및 전자선살아있는 유기체에 대한 γ- 조사의 영향은 1960 년대 초 이미 조사되었다. 현재, γ- 조사는 에틸렌 옥사이드 (EO) 외에 생물학적 조직으로부터 건조한 상업용 의료 제품을 멸균하는 가장 일반적인 방법입니다. 전 세계 정부 표준에 따르면 재료에 25kGy를 적용해야하지만 경우에 따라 바이오 버든에 따라 15kGy도 몇 분율로 적용될 수도 있습니다. 방사선은 살아있는 유기체의 DNA에 직접 영향을 미칩니다. 또한, 단백질, 지질 및 내 독소와 같은 다른 중합체 구조에 영향을 미치는 라디칼이 형성된다. 포자와 같은 지속적인 상태는 신진 대사가 높은 유기체보다 덜 민감합니다. 프리온은 거의 영향을받지 않습니다 [ 450 , 451 , 452, 453 ]. γ- 조사는 또한 콜라겐 구조에 영향을 미친다. 관찰 된 효과는 재료의 습도에 의해 크게 영향을받습니다. 습도가 높으면 콜라겐이 가교됩니다. 효소에 대한 용해도 및 감수성은 종종 감소합니다. 대조적으로, 건식 콜라겐은 종종 더 높은 구조를 잃고 주쇄에서 절단됩니다. 또한, 고용량에서 삼중 나선이 변성되고 아미드 질소가 유리된다 [ 439 , 454 , 455 , 456 , 457 ]. 보다 최근에는, 전자선 살균이 감마선 조사의 대안으로서 조사되어왔다. 두 방법 사이의 비교는 현저한 차이를 보이지 않았지만,이 기술은 γ- 방사선만큼 흔하지는 않다 [ 451 , 458 , 459 ]. 높은 안전 표준으로 인해 조사 시설은 운영 비용이 많이 듭니다. 따라서 종종 외부 공급 업체가 γ- 조사를 수행합니다. 고객의 경우, 멸균 대상 물질이 예를 들어 국소 과다 복용에 민감한 경우 통제 할 수없는 조건이 발생합니다. 분류 된 방사선은 가능하지만 더 비싸다. 에틸렌 옥사이드 (EO)에틸렌 가스를 100 % 또는 질소 혼합 CO 2, 90 시간까지 33 최대 45 ° C 사이의 약간 승온에서 (50)와 80 %의 상대 습도에서 기체 화학 살균제로서 사용된다. EO는 스펀지 또는 섬유질 구조와 같은 콜라겐 물질 내부뿐만 아니라 포장 구멍 (Tyvec ® )을 통해 쉽게 확산 됩니다. 그러나 습식 물질의 멸균은 불가능합니다. EO는 독성, 암성, 변이원성 및 폭발성입니다. 따라서 가스를 분배하고 해독하기 위해 광범위한 안전 설비가있는 밀폐 된 챔버에 적용됩니다. 안전상의 이유로, 처리 된 물질을 건조하고 따뜻한 공기로 강하게 씻고 독성 잔여 물을 증발시키는 것이 중요합니다 [ 460 , 461 ]. EO는 알킬화제이다. 콜라겐 물질의 구조 또는 기계적 안정성에 미치는 영향은 미미하거나 아직 미미하다 [ 462 , 463 ]. 그러나 콜라겐의 측쇄에 미치는 영향은 여전히 논란의 여지가 있습니다. Lys 및 Hyl 그룹은 일부 저자에 의해 변형 된 것으로 관찰되었으며, 이는 콜라게나 제에 의한 분해 속도를 감소시켰다 [ 4 , 462 ]. 다른 사람들은 일차 아미노 그룹에 대한 어떠한 행동도 관찰하지 않았다 [ 464 ]. 퍼 옥소 아세트산 (PAA)PAA는 조직 동종 이식편, 예를 들어 피부, 연골 및 인대를 멸균하기 위해 에탄올과 조합하여 사용된다. 재료는 젖은 상태로 처리됩니다. 멸균 제는 멸균 PBS 또는 식염수 용액으로 완전히 교환해야하며이 교환은 멸균 조건에서 수행해야합니다. 본 방법은 임플란트를 멸균하는 것이 당국에 의해 허용되지만, 최종 제품 멸균은 아니다 [ 451 , 465 , 466 ]. 따라서 무균 세척 단계를 통해 PAA의 모든 잔재를 제거해야합니다. 콜라겐에서 이용 가능한 메티오닌은 산화되지만 다른 아미노산에는 영향을 미치지 않는 것으로 보입니다 (자체 결과, 미공개). 물리적 손상이 적고 다른 화학적 특성은 약간만 영향을받습니다. 살균 효율은 γ- 처리 [ 451 ] 와 유사하다 . 가스 플라즈마 처리가스 플라즈마만으로는 콜라겐 물질, 특히 스폰지를 살균하는 데 사용할 수 없습니다. 살균 효과는 UV 방사선, 활성 가스 분자 및 라디칼에 의해 달성되지만 이러한 종의 침투 깊이는 낮습니다. 따라서이 공정은 표면을 살균하는 데만 적합하며 생체 재료를 제외한 많은 응용 분야에서 확립되었습니다 [ 467 , 468 , 469 , 470 ]. 가스 플라즈마가 과산화수소 증기 (Sterrad ® ) 와 함께 적용될 때 더 나은 결과를 얻을 수 있습니다 . 최근 내시경과 같은 의료 기기를 멸균하기 위해 조사 된 방법이 있습니다. 생체 물질에 대한 영향은 지금까지 포괄적으로 조사되지 않았으며 단 하나의 연구 만 콜라겐 스폰지에 대한 살균 능력을 입증했습니다. 스폰지는 강하게 특성화되지 않았습니다. 이 레이아웃에서의 멸균은 저압으로 적용되는 기화 된 과산화수소에 의해 달성됩니다. 이것은 튜브뿐만 아니라 모공에도 강하게 침투합니다. 진공 적용 후 플라즈마가 방출된다. 살균을 달성하기보다는 기체상에서 과산화수소 분자를 해독하는 데 특히 사용됩니다 [ 471 ]. 초 임계 이산화탄소 (COsc2) 첨가제과산화수소 및과 아세트산 (PAA)은 콜라겐 물질을 효과적으로 살균하는 것으로 나타났다. 따라서 CO에서 해결되는 소량의 과산화수소 또는 PAA를 적용하여 동결 건조 된 물질을 성공적으로 멸균합니다.sc2. 건조 물질은 과산화수소 및 CO에 투과성이 있는 Tyvec ® 백에 포장되어 있습니다.sc2. 박테리아 및 포자의 충분한 불 활성화를 달성하기 위해서는 압력을 주기적으로 적용해야하며 적은 양의 첨가제 만이 필요하다 [ 472 , 473 , 474 , 475 , 476 , 477 ]. 이 기술은 산화제, 예를 들어 스펀지, 탈장 임플란트 또는 포일로 이미 처리 된 콜라겐 물질에 특히 유용합니다. 준비 기술에는 종종 과산화수소를 사용하는 오염 제거 단계가 포함되기 때문입니다 [ 478 , 479 ]. 결론시중에서 판매되는 콜라겐 기반 의료 제품은 일상적인 기술로 정제 및 준비됩니다. 그것들은 재건 수술에 성공적으로 적용되며 가능한 적용 범위가 더욱 증가하고 있습니다. 제조 및 가공 기술의 변형에 의해, 콜라겐은 넓은 범위에서 특성을 조정할 수있는 많은 다른 재료로 제조 될 수있다. 가공 및 결과 재료가 수십 년 동안 조사되었지만 재료 과학 및 생산 변형의 엔지니어링은 아직 최대치가 아닙니다. 한 가지 이유는 많은 지식이 전통을 기반으로하고 또 다른 이유는 콜라겐 구조와 물질 거동이 습도, 종류 및 농도의 완충액과 같은 많은 주변 조건, 가교를 포함한 모든 수준의 구조의 안정성에 달려 있다는 것입니다. 또한, 적은 양의 첨가제는 구조적, 화학적, 물리적 및 생물학적 물질 특성에 영향을 미친다. 그러나 가공 된 콜라겐 재료의 특성을 예측할 수있는 수학적 모델이나 결과적으로 재료 특성에 대한 다양한 처리 단계의 효과 및 처리를 시뮬레이션하는 모델은 없습니다. 따라서, 처리 및 분석을위한 정교한 자동화 시스템과 함께 충분한 순도 및 선택된 예측 가능한 재료 특성을 달성하기 위해 처리 시간 단축과 관련하여 새로운 개발의 가능성이 가장 높습니다. 콜라겐 물질의 형태는 현재 필름, 겔, 분말, 스펀지와 같은 단순한 구조 또는 심낭, SIS 또는 진피 스플릿과 같은 평평한 물질의 저장된 원래 조직 구조로 제한된다. 외과의는보다 복잡한 형태를 스스로 준비해야하고, 임플란트 주변의 수용 조직은 이식 된 조직을 재 혈관 화하고 교체해야합니다. 최근에, 전체 기관 및 기관 부분의 비 셀러 화 (decelluarization)는 선박 트리를 포함한 원래의 구조를 저장함으로써 ECM의 복잡한 구조를 준비 할 수있게하는 일상적인 기술이되었다. 이러한 복잡성은 이점이 될 것이라 약속되었지만 그러한 재료가 당국에 의해 수용되는 것을 목표로하는 경우 순도 및 품질 관리의 예상 요구 사항은 말할 것도없고, 그러한 아키텍처의 재세 포화는 여전히 도전 과제이다. 따라서, 복잡한 탈세 포화 된 기관과 필름, 스펀지 및 분말과 같은 시판되는 단순한 형태 사이의 분야는 정제 된 중간체를 기초로하는 새로운 새로운 제조 기술을 위해 개방되어있다. 세포 적합성 중간체를 달성하기 위해 정제에 필요한 표준 기술이 이미 이용 가능하지만, 자동화가 공정 속도를 높이고 최적화 할 가능성이있다. 복합 구조물은 상이한 건조 기술, 다공질 구조물의 제조 또는 방사, 몰딩 또는 첨가제 제조 기술과 같은 주조 단계와의 가교와 같은 추가 기능을 수행하는 멸균 단계를 포함하는 복합 복합 기술에 의해 제조 될 수있다. 마지막으로, 상이한 콜라겐 유형, 라미닌, 피브로넥틴, 엘라스틴 또는 콜라겐 유사 펩티드와 같은 추가 ECM 유래 성분의 사용은 복잡한 물질을 제조 할 가능성이 훨씬 높지만, 목표 물질이 습한 생물학적 환경에서 어떻게 작용하는지에 대한 지식에 기초한다. 구조는 살아있는 세포와 결합되거나 클리닉에서 직접 사용될 수 있습니다. 즉, 툴박스는 새롭게 떠오르는 가공 기술과 표준화 된 중간체로 채워져 있습니다. 반면에 조합은 더 정교 해집니다. 그러나 복잡한 재료의 자동 생산은 시작에 불과합니다. 주요 도전은 많은 구조적 요소로 구성된 이러한 하이브리드 재료의 충분한 기계적 안정성과 혈관 화를 달성하는 것입니다. 정제 된 ECM 기반 재료의 지식 및 공급과보다 정교한 제조 및 성형 기술로 인해 조잡한 구조의 하이브리드를 쉽게 제조 할 수 있으며 가까운 시일 내에 더욱 개선 될 것입니다. 그러나, 공학 기술에 의해 혈관 나무와 같은 매우 복잡한 구조를 제조하는 것이 아니라 생물학적 시스템이 스스로 재구성되도록하는 것이 더 적합 해 보인다. 이는 시험 관내 또는 수용자가 생체 내에서 모세관, 신경 또는 대사 구조를 형성하는 것을 의미한다. 생물학적 시스템은 복잡한 분자 적 요구와 개인의 요구 사항을 따르는 현미경 수준에서 간단한 분자와 구조를 복잡한 구조로 조립할 수있는 잠재력을 가지고 있습니다. 첨가제 제조를위한 재료로서 콜라겐의 사용은 단지 시작일 뿐이며 콜라겐 계 펩타이드이며 다른 ECM 유래 폴리머와의 조합은 어려운 개발을 약속한다.

|