-
평점

-
작성일 2020-10-21 19:06:00
-
추천
 추천하기 추천하기
-
조회수 200
콜라겐 VI는 피부에서 풍부하게 발현되는 세포 외 기질 분자입니다. 그러나 모낭 성장에서 콜라겐 VI의 역할은 알려져 있지 않습니다. 여기에서 콜라겐 VI가 모낭에 강하게 축적되고 피부 상처에 의해 현저하게 상향 조절된다는 것을 보여줍니다. Col6a1-/- 마우스 에서 콜라겐 VI가 부족하면 생리적 조건 하에서 모발 순환과 성장이 지연되지만 피부 재생에 영향을주지 않고 상처 유발 모발 재성장을 촉진합니다. 반대로, 정제 된 콜라겐 VI의 추가는 Col6a1-/- 마우스 에서 비정상적인 상처 유발 모발 재성장을 구제 합니다. 기계 론적 연구에 따르면 Col6a1-/- 의 상처 유발 모발 재성장이 증가 함이 밝혀졌습니다.마우스는 Wnt / β-catenin 신호 전달 경로의 활성화에 의해 촉발되며이 경로의 억제에 의해 폐지됩니다. 이러한 발견은 세포 외 기질 (ECM)과 모낭 재생 사이의 필수적인 관계를 강조하고 콜라겐 VI가 탈모 및 기타 피부 관련 질병에 대한 잠재적 인 치료 표적이 될 수 있음을 시사합니다.DKK-1 / dickkopf 관련 단백질 1 / ECM / 세포 외 기질 / K79 / 각질 79 소개포유류 피부는 모낭 간 표피, 피지선 및 모낭을 포함하여 세 개의 상피 구획을 포함하는 복잡한 기관입니다 (Stenn과 Paus, 2001). 성인 포유류의 각 모낭은 성장기 (성장), 퇴행 (회귀) 및 휴지기 (정지) 단계를 거칩니다.이 과정은 팽창 세포와 이차 모발을 포함한 줄기 세포 그룹에 의존하는 과정입니다.놀랍게도 상처 부위 주변의 모낭에서 상피 줄기 세포의 발현 패턴과 모낭 상피 세포의 성장 및 활성화를 조정하는 신호는 배아 모발 발달과 유사합니다.
신호 전달이 피부 상처 후 모낭 성장 중에 어떻게 조절되는지는 명확하지 않습니다.상피 줄기 세포 발달의 시작은 틈새 시장으로 정의되는 환경 신호에 의해 촉발되는 것으로 나타났습니다.
Chen 외, 2013, 2014a, 비). 가장 풍부한 형태의 콜라겐 VI는 별개의 유전자 ( Col6a1 , Col6a2 , Col6a3 )에 의해 암호화 된 3 개의 α1 (VI), α2 (VI) 및 α3 (VI) 사슬로 구성되어 있지만 최근 연구에서 추가 유전자 ( Col6a4 , Col6a5 , Col6a6 ) α3 (VI)와 높은 유사성을 가진 세 사슬에 대한 코딩 (Fitzgerald et al., 2008; Gara et al., 2008). 우리의 최근 연구는 콜라겐 VI가 부상 후 적절한 근육 재생에 필요한 성인 근육 줄기 세포 틈새의 핵심 구성 요소임을 보여주었습니다.
그러나 콜라겐 VI가 모낭 성장과 재생에 기여하는지 여부는 아직 완전히 알려지지 않았습니다.여기서 우리는 콜라겐 VI가 모낭에 풍부하게 축적되고 피부 상처에 의해 상향 조절된다는 것을 보여줍니다.
콜라겐 VI-null ( Col6a1 -/- ) 마우스를 사용하여 Col6a1 유전자 의 표적 비활성화가 ECM에서 콜라겐 VI의 조립 및 분비를 방지합니다 Wnt / β-catenin 신호 전달 경로를 조절하여 상처 유발 모발 재성장을 촉진한다는 것을 보여줍니다.
결과콜라겐 VI는 모낭에서 발현되며 피부 상처에 의해 조절됩니다.모낭에서 콜라겐 VI의 침착을 분석하기 위해 우리는 콜라겐 VI 사슬에 대한 다른 항체로 쥐 피부에 라벨을 붙였습니다. 면역 형광 분석은 콜라겐 VI가 돌출, 피지선, 모발 및 진피 유두를 포함하여 모낭의 다른 영역에 풍부하게 침착되어 있음을 보여주었습니다
( 그림 1a ). 이중 면역 형광은 α1 (VI) 및 α3 (VI) 사슬이 케라틴 15 (K15) 양성 벌지 줄기 세포에 인접 해 있고 부분적으로 K15와 공존하여 콜라겐 VI가 벌지 줄기 세포 틈새의 세포 외 성분임을 시사합니다
이러한 발견은 모낭에서 콜라겐 VI의 잠재적 인 역할을 시사합니다.
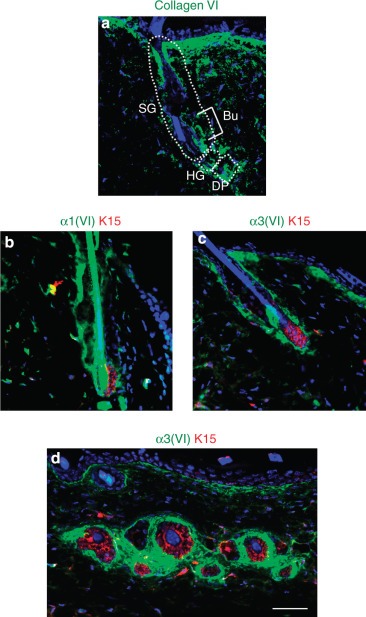 그림 1 콜라겐 VI는 모낭에 침착됩니다. ( a ) 야생형 성인 마우스의 모낭에서 콜라겐 VI에 대한 면역 형광. ( b – d ) 야생형 마우스의 모낭에서 α1 (VI) (녹색, b ) 및 α3 (VI) (녹색, c 및 d ) 와 케라틴 15 (K15; 빨간색)의 공동 면역 형광 표지 . 점선 영역은 표시된대로 모낭의 진피 유두 (DP), 모낭 (HG) 및 피지선 (SG)을 표시합니다. 핵은 Hoechst (파란색)로 염색되었습니다. 축척 막대 = 50 μm. 부, 부풀어. 그림 1 콜라겐 VI는 모낭에 침착됩니다. ( a ) 야생형 성인 마우스의 모낭에서 콜라겐 VI에 대한 면역 형광. ( b – d ) 야생형 마우스의 모낭에서 α1 (VI) (녹색, b ) 및 α3 (VI) (녹색, c 및 d ) 와 케라틴 15 (K15; 빨간색)의 공동 면역 형광 표지 . 점선 영역은 표시된대로 모낭의 진피 유두 (DP), 모낭 (HG) 및 피지선 (SG)을 표시합니다. 핵은 Hoechst (파란색)로 염색되었습니다. 축척 막대 = 50 μm. 부, 부풀어.
또한 피부 상처가 성인 마우스의 콜라겐 VI 발현에 영향을 미치는지 여부를 조사했습니다. 실시간 역전사 -PCR은 Col6a1 , Col6a2 및 Col6a3 전 사체 의 수준이 상처 후 4 일과 8 일에 증가 했음을 보여주었습니다 ( 그림 2a–c ). 웨스턴 블롯 분석에 따르면 α1 (VI)의 단백질 수준은 상처 후 2 일과 4 일에 처음 감소한 다음 상처 후 8 일에 증가한 반면, α3 (VI) 수준은 상처 후 2 일에 증가했습니다 ( 그림 2d 및 e ). Immunofluorescence는 피부 상처 후 콜라겐 VI의 수준이 증가했음을 보여주었습니다 ( 그림 2f). 종합하면, 이러한 데이터는 콜라겐 VI의 발현이 피부 상처에 대해 강하게 조절됨을 나타내며, 피부 병리에서이 분자의 잠재적 인 역할을 지적합니다.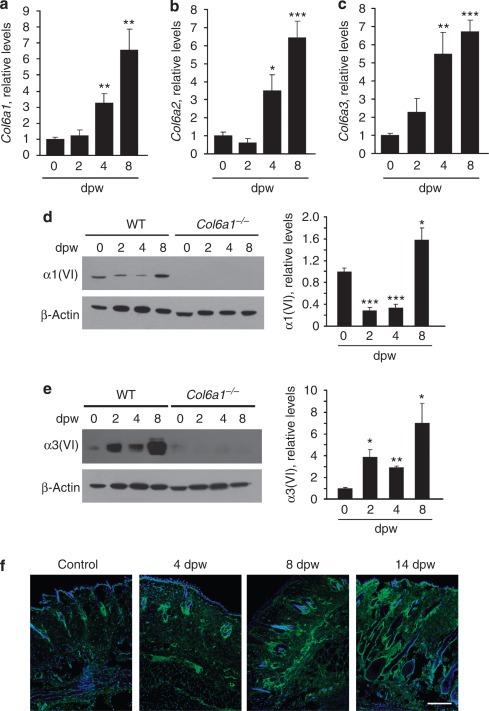
그림 2
피부 손상은 콜라겐 VI 발현을 조절합니다. ( a – c ) ( a ) Col6a1 , ( b ) Col6a2 , ( c ) 손상되지 않은 상태 및 표시된 상태에서 야생형 (WT) 피부의 Col6a3 전 사체에 대한 실시간 역전사 -PCR (RT-PCR) 상처 후 횟수 ( n = 5; * P <0.05; ** P <0.01; *** P <0.001). ( d 및 e , 왼쪽 패널) WT 및 Col6a1 에서 α1 (VI) 및 α3
(VI)에 대한 웨스턴 블롯 − / −부상을 입지 않은 상태에서 그리고 상처 후 지정된 시간에 피부. ( d 및 e , 오른쪽 패널) α1 또는 α3 (VI) 대 액틴의 밀도 측정 정량화 ( n = 4–5; * P <0.05; ** P <0.01; *** P <0.001). ( f ) 손상되지 않은 상태에서 상처 후 표시된 시간에 WT 피부에서 콜라겐 VI (녹색)의 면역 형광 표지. 상처가 난 피부의 분석은 상처 가장자리 가까이에서 수행되었습니다. 핵은 Hoechst (파란색)로 염색되었습니다. 축척 막대 = 200 μm. dpw, 상처 후 일.
콜라겐 VI의 부족은 상처로 인한 모발 재성장을 촉진합니다콜라겐 VI가 근육 및 말초 신경 재생에 필요하다는 이전 발견을 기반으로합니다 이 가설을 테스트하기 위해 야생형 및 Col6a1 -/- 마우스 의 면도 된 등쪽 피부에 전체 두께의 절제 상처 (1cm 2 정사각형)를 만들고 2 주 동안 상처 부위를 모니터링했습니다. 놀랍게도 예기치 않게, 우리는 상처 치유가 두 가지 유전자형에서 유사하다는 것을 발견했지만 상처 유발 모발 재성장은 Col6a1 -/- 마우스 에서 현저하게 가속화되었습니다 ( 그림 3a 및 b ). 이러한 결과를 추가로 확인하기 위해 마우스에 3 개의 6mm 절개 상처를 입힌 또 다른 피부 손상 모델을 수행했습니다. 결과는이 모델에서 상처로 인한 모발 재성장이 Col6a1 에서도 유의하게 촉진 되었음을 보여줍니다.-/- 마우스는 야생형 마우스와 비교했을 때 ( 도 3c ), 마우스가 모발 만 면도를 받았을 때 두 유전자형에서 모발 성장이 비슷했습니다 ( 보충 그림 S1 온라인). 헤 마톡 실린 및 에오신 염색은 Col6a1 -/- 마우스 에서 상처 유발 모낭 성장기의 개시가 더 높았고, 야생형 마우스가 아닌 Col6a1 -/-의 모낭은 14 일째에도 성장기에 있음을 보여주었습니다. 상처 후 ( 그림 3d ). 전체적으로, 이러한 발견은 콜라겐 VI의 부족이 상처로 인한 모발 재성장을 촉진한다는 것을 나타냅니다.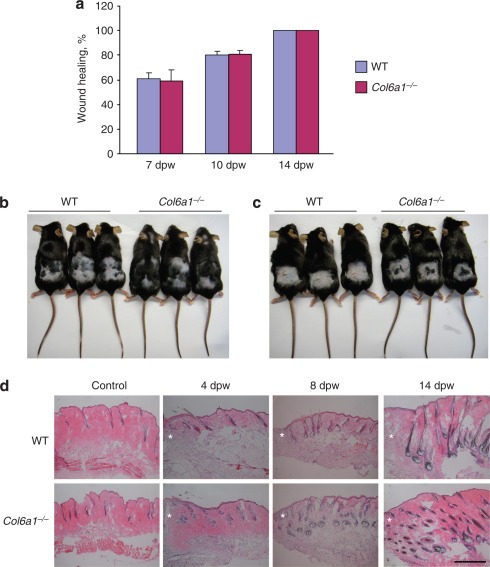
그림 3 콜라겐 VI의 부족은 상처 치유에 영향을 미치지 않지만 상처로 인한 모발 재성장을 촉진합니다.
( a ) 전체 두께 등쪽 피부 의 1 cm 2 정사각형을 절제 한 후 야생형 (WT) 및 Col6a1 -/- 마우스 에서 초기 상처 부위의 백분율 정량화 ( n = 3). ( b 및 c ) Col6a1 -/- 마우스의 상처 유발 모발 재성장 은 전체 두께 등쪽 피부 ( b ) 의 1cm 2 정사각형을 절개하거나 3 개의 6mm 절개를 수행 하여 얻은 손상 모델에서 WT 마우스보다 빠릅니다 상처 ( c). 상처 14 일째에 사진을 찍었다.
( d ) WT 및 Col6a1 -/- 생쥐 에서 상처 입은 피부에 헤 마톡 실린 및 에오신 (H & E) 염색이 손상되지 않은 상태에서 상처 후 지정된 시간에 ( n = 3-4). 별표는 상처 가장자리를 표시합니다. 축척 막대 = 200 μm. dpw, 상처 후 일.
Col6a1 -/- 마우스 의 촉진 된 모발 성장이 상처에 의해 유도 되는지 확인하기 위해 생리적 조건 하에서 두 유전자형의 마우스에서 모발주기를 분석했습니다. 헤 마톡 실린 및 에오신 염색은 생리적 출생 후 모발주기 동안 야생형 마우스와 비교할 때 Col6a1 -/- 마우스 에서 모발 순환이 지연되었음을 보여주었습니다 ( 보충 그림 S2a 온라인). 유사한 결과가 탈모 유도 성인 모발 사이클링에 의해 표시되었습니다 이러한 발견은 콜라겐 VI의 부족이 생리적 조건 하에서 모발 순환과 성장을 지연 시킨다는 것을 시사합니다.
Col6a1 -/- 마우스 의 강화 된 것 유도 모발 재성장은 K79의 상향 조절, 모낭 줄기 세포의 수 증가 및 Wnt / β- 카테닌 신호 전달의 활성화를 포함합니다.케라틴 -79 (K79)-양성 세포는 모발 재생을 시작하는 이동성 상피 세포 집단입니다 웨스턴 블롯 분석은 콜라겐 VI의 제거가 생리적 조건에서 K79 발현을 약화 시켰지만 , Col6a1 -/- 마우스 의 상처 입은 피부에서 K79 단백질 수준이 상처 후 8 일째에 야생형 마우스보다 높았다 ( 도 4a ). 위에서 논의한 바와 같이, 콜라겐 VI는 벌지 줄기 세포 틈새의 구성 요소입니다.따라서 우리는 줄기 세포가 Col6a1 -/- 의 향상된 상처 유발 모발 재성장에 기여하는지 조사했습니다.쥐. 이 목표를 위해 우리는 모낭 각질 세포 줄기 세포의 뚜렷한 집단 인 CD39 및 α6 인테그린 (CD49f) 이중 양성 세포를 분석했습니다
(Trempus 외, 2003; Morris et al., 2004; Jensen et al., 2008). 유세포 분석은 CD34- / CD49f- 양성 줄기 세포가 생리 학적 조건 하에서 대조군과 비교하여 Col6a1 -/- 마우스 에서 약간 감소 (상당하지는 않지만)되었지만 , 상처 입은 피부에서 CD34- / CD49f- 양성 세포의 비율은 Col6a1 -/- 마우스는 상처 후 8 일에 야생형 마우스보다 유의하게 높았다 ( 도 4b ). 전체적으로, 이러한 발견은 K79- 양성 세포 및 CD34- / CD49f- 양성 줄기 세포가 Col6a1 -/- 마우스 의 향상된 상처 유발 모발 재성장에 관여 함 을 시사한다 .
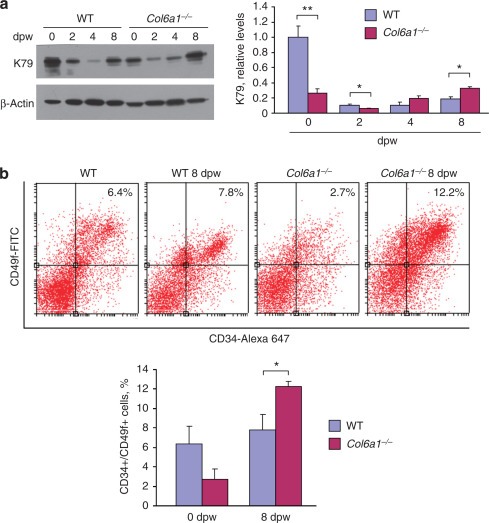 그림 4 콜라겐 VI의 절제는 피부 상처 후 케라틴 79 (K79) 발현과 CD34- / CD49f 양성 세포를 증가시킵니다. 그림 4 콜라겐 VI의 절제는 피부 상처 후 케라틴 79 (K79) 발현과 CD34- / CD49f 양성 세포를 증가시킵니다.
( a , 왼쪽 패널) 손상되지 않은 상태에서 상처 후 표시된 시간에 야생형 (WT) 및 Col6a1 -/- 마우스의 피부에서 K79에 대한 웨스턴 블롯 . ( a , 오른쪽 패널) K79 대 액틴의 밀도 계 정량화 ( n = 4; * P <0.05; ** P <0.01). ( b , 상단 패널) WT 및 Col6a1 -/- 마우스 로부터 분리 된 등쪽 피부 각질 세포에서 줄기 세포 마커 CD34 및 CD49f를 사용한 유세포 분석 분석 . ( b, 하단 패널) 유세포 분석 데이터의 정량화 ( n = 3-4). dpw, 상처 후 일.
Wnt / β-catenin 신호 전달은 상처 유발 모발 재성장의 주요 신호 전달 경로입니다.리는 야생형 및 Col6a1 -/- 마우스 의 상처 입은 피부에서이 경로에 대한 철저한 조사를 수행했습니다 . 웨스턴 블 롯팅은 두 유전자형 모두에서 피부 상처시 β- 카테닌 수치가 감소했지만, Col6a1 -/- 마우스 의 상처 입은 피부에서 β- 카테닌 수치는 상처 후 8 일째에 야생형 마우스보다 유의하게 높았다 ( 도 5a ). . 면역 형광 분석은 모낭에서 β- 카테닌 표지가 상처 후 8 일째에 야생형 마우스보다 Col6a1 -/- 마우스 에서 훨씬 더 강하다는 것을 확인했습니다 ( 그림 5b).). 또한, 우리는 핵 분획 추출물에서 β-catenin 수준을 조사한 결과, 상처 후 8 일째에 야생형 마우스와 비교했을 때 Col6a1 -/- 마우스 에서 현저하게 증가했음을 발견했습니다 ( 도 5c ). 또한, 상처 후 8 일째에 Wnt 억제제 dickkopf 관련 단백질 1 (DKK-1)에 대한 면역 형광 은 야생형 마우스보다 Col6a1 -/- 마우스의 모낭에서 더 낮은 라벨링을 나타 냈습니다 ( 도 5d ). 이러한 발견은 Wnt / β-catenin 신호 전달이 Col6a1 -/- 마우스 의 향상된 상처 유발 모발 재성장에 관여한다는 것을 나타낸다 .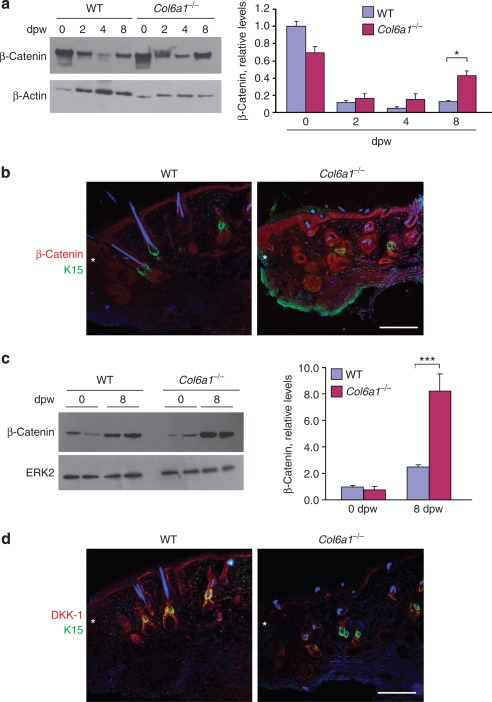
그림 5 콜라겐 VI의 부족은 피부 상처 후 Wnt / β-catenin 신호 전달을 활성화합니다.
( a 및 c , 왼쪽 패널) ( a ) 세포질 및 ( c ) 야생형 (WT) 및 Col6a1 -/- 피부에서 손상되지 않은 상태에서 상처 후 표시된 시간에 핵 β- 카테닌에 대한 웨스턴 블롯 . ( a 및 c , 오른쪽 패널) ( a ) β-catenin 대 액틴 또는 ( c ) β-catenin 대 ERK2 ( n = 4–5; * P <0.05; *** P <0.001)의 밀도 측정 정량화 . ( b 및 d) 상처 후 8 일째에 야생형 및 Col6a1 -/- 마우스의 피부에서 β- 카테닌 (적색, b ) 또는 DKK-1 (적색, d )과 함께 K15 (녹색)의 공동 면역 형광 표지 . 별표는 상처 가장자리를 표시합니다.
핵은 Hoechst (파란색)로 염색되었습니다. 축척 막대 = 200 μm. DKK-1, dickkopf 관련 단백질 1; dpw, 상처 후 일수; ERK2, 세포 외 신호 조절 키나아제 2; K15, 각질 15.
노치 신호는 배아 및 산후 모발 항상성에 관여합니다. Notch를 비활성화하면 탈모가 발생합니다 (Vauclair et al., 2005). Lhx2는 모낭에서 줄기 세포 정지와 활성화 사이의 전환을 제어하는 데 중요한 역할을하는 Lim-homeodomain 전사 인자이며, Lhx2 결핍은 상처 유발 모발 성장 촉진과 관련이 있습니다.상처 후 8 일째의 웨스턴 블롯 및 / 또는 면역 형광 분석은 Col6a1 -/- 마우스 의 상처 입은 피부에서 Notch1 및 Lhx2의 수준 이 야생형 마우스와 유사 하다는 것을 보여주었습니다 ( 보충 그림 S3a-c 온라인). 종합하면, 이러한 데이터는 K79의 상향 조절 및 Wnt / β- 카테닌 경로의 활성화가 Col6a1 -/- 마우스 의 향상된 상처 유발 모발 재성장에 기여할 수 있음을 나타냅니다 .
Col6a1 -/- 마우스 의 증가 된 상처 유발 모발 재성장 은 콜라겐 VI의 첨가 또는 Wnt / β- 카테닌 경로의 억제에 의해 제거됩니다상처 유발 모발 재성장에서 콜라겐 VI의 역할과 Wnt / β-catenin 신호 전달 경로의 조절과 관련된 기본 분자 메커니즘을 확인하기 위해 Col6a1 -/- 마우스를 정제 된 천연 콜라겐 VI 또는 Wnt / β- 카테닌으로 처리했습니다. 피부 상처 후 억제제 ICG-001. 특히, 개선의 발모 Col6a1는 - / - 마우스는 정제 된 콜라겐 VI 단백질 (첨가하여 구출 도 6a )과 ICG-001 (로 처리하여 도 6b), 이는 상처 유발 모발 재성장에서 콜라겐 VI의 억제 효과가 Wnt / β-catenin 경로에 의해 조절됨을 시사합니다. 헤 마톡 실린 및 에오신 염색은 정제 된 콜라겐 VI 단백질 또는 ICG-001 처리가 Col6a1 -/- 마우스 에서 상처 유발 모낭 성장기 시작을 억제 함을 입증했습니다 ( 도 6c ). 또한, 웨스턴 블 롯팅은 정제 된 콜라겐 VI 또는 ICG-001의 첨가가 Col6a1 -/- 마우스 에서 상처 유발 K79 및 β- 카테닌의 상향 조절을 차단 함을 보여 주었다 ( 도 6d ). 전체적으로, 이러한 데이터는 Col6a1 -/- 마우스 의 향상된 상처 유발 모발 재성장이 Wnt / β- 카테닌 신호 전달 경로의 활성화에 의해 조절 된다는 것을 나타냅니다 .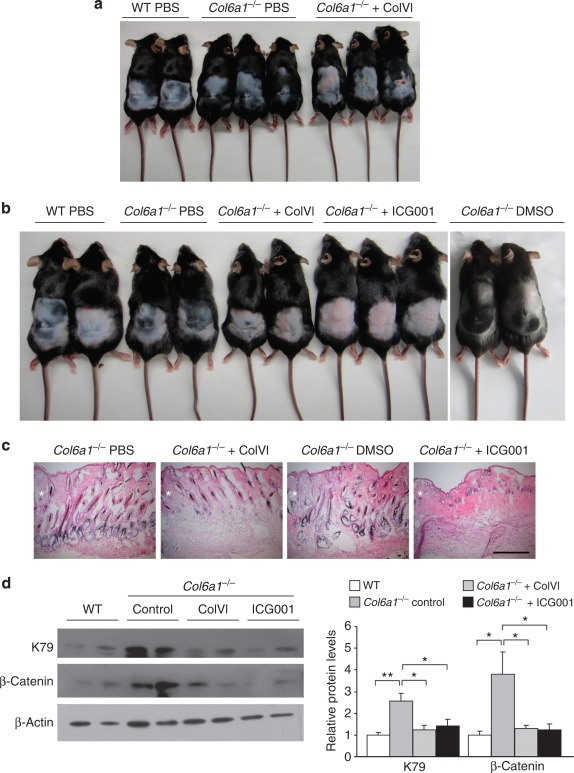
그림 6 정제 된 콜라겐 VI 또는 Wnt / β- 카테닌 억제제는 Col6a1 -/- 마우스 의 증가 된 상처 유발 모발 재성장을 폐지합니다 .
( a 및 b ) 상처 후 14 일째 에 Col6a1 -/- 마우스 의 상처 유발 모발 재성장에 표시된 치료 효과를 보여주는 대표적인 이미지 ( n = 4-6). ( c ) 상처 후 14 일째에 지정된 조건 하에서 Col6a1 -/- 마우스 의 상처 입은 피부에서 헤 마톡 실린 및 에오신 (H & E) 염색 ( n = 3-4). 별표는 상처 가장자리를 표시합니다.
축척 막대 = 200 μm. ( d, 왼쪽 패널) 표시된 조건 하에서 상처 후 8 일째 에 야생형 (WT) 및 Col6a1 -/- 마우스 의 상처 입은 피부에서 케라틴 79 (K79) 및 β- 카테닌에 대한 웨스턴 블롯 . ( d , 오른쪽 패널) K79 또는 β- 카테닌 대 액틴의 밀도 측정 정량화 ( n = 4; * P <0.05; ** P <0.01). PBS 중의 콜라겐 VI ( 하루 3mg kg - 1) 또는 1 % DMSO (5 mg kg - 1 일) 중의 ICG-001을 상처 후 4 일째에 시작하여 상처 가장자리로부터 0.5 cm 떨어진 곳에 피하 투여 하였다.
ColVI, 정제 된 콜라겐 VI; PBS, 인산염 완충 식염수.
이전의 마이크로 어레이 연구에 따르면 벌지 줄기 세포에서 Col6a1 및 Col6a2 의 발현 수준이 분화 된 각질 세포에서보다 높으며, 이는 콜라겐 VI가 벌지 기능과 모발 발달에 기여할 수 있음을 시사합니다. 그러나 그러한 역할에 대한 직접적인 증거는 여전히 부족했습니다 (Fujiwara et al., 2011). 이 연구에서 우리는 콜라겐 VI가 모낭에서 뚜렷한 분포를 갖고 피부 상처에 반응 함을 보여 주며, Col6a1-/- 마우스 의 콜라겐 VI가 부족 하면 모낭주기 가 바뀌고 상처 유발 모발에 현저한 영향을 미친다는 것을 입증했습니다. 그러나 상처 치유는 때때로 섬유증이나 흉터에 의한 부적절한 조직 재생을 초래하며, 특히 성인의 피부 상처 (Gay et al., 2013). 상처 흉터와 조직 재생을 제어하는 기본 메커니즘은 아직 완전히 이해되지 않았습니다 대 식세포 기능을 조절하여 말초 신경 재생 (Chen 외, 2015), 우리는 원래 Col6a1-/- 마우스가 피부 재생에 결함이있을 수 있다고 예측했습니다 .흥미롭게도 이전 연구에서 Col6a1-/- 마우스 의 콜라겐 VI가 부족 하면 심근 경색 후 심장 기능, 구조 및 리모델링이 개선 된다는 사실이 입증되었습니다 (Luther et al., 2012). 이러한 발견은이 ECM 분자가 재생 중에 각 조직의 특정 상황에 기인 할 수있는 별개의 조직에서 다른 역할을한다는 것을 시사합니다. 다른 기관에서 재생하는 동안 콜라겐 VI의 특정 기능과 관련된 자세한 기본 메커니즘을 이해하려면 추가 연구가 필요합니다.Col6a1-/- 마우스가 심근 경색 후 심장 기능이 향상 되었다는 이전의 예상치 못한 발견과 유사합니다Col6a1-/- 마우스 의 촉진 된 모발 재성장이 상처에 의해 유발 되는지 추가로 확인하기 위해 생리적 조건 하에서 두 유전자형 모두에서 모낭주기를 조사한 결과 야생과 비교했을 때 Col6a1-/- 마우스 에서 모낭주기가 지연된다는 것을 발견했습니다. -유형 마우스. 이러한 결과는 콜라겐 VI의 부족으로 유발 된 상처 유발 모발 재성장이 상처 관련 세포 성분 및 / 또는 신호에 의해 조절되어야 함을 시사합니다.K79 양성 세포는 Notch 신호 전달 경로와 관계없이 모발 형태 형성 및 재생을 시작하는 데 필수적인 최근 확인 된 상피 세포 집단입니다 (Veniaminova et al., 2013). 흥미롭게도, 우리의 데이터 는 야생형 마우스보다 Col6a1-/- 마우스 의 상처 입은 피부에서 K79에 대해 더 높은 면역 표지를 보여 주지만 Notch1에 대해서는 그렇지 않습니다 . 이러한 데이터는 K79 양성 세포의 조절 이 Notch 신호와 독립적으로 Col6a1-/- 마우스 에서 증가 된 모발 재성장과 상관 관계가 있음을 시사합니다 .Wnt / β-catenin 경로는 생리 학적 및 병리학 적 조건 모두에서 배아 및 성인 모낭 성장을 조절하는 데 중심적인 역할을합니다. 예를 들어, Wnt / β-catenin 신호 전달의 활성화는 배아 모낭 발달의 시작에 필수적이라는 것이 밝혀졌습니다.마우스 표피에서 Wnt7a의 과발현은 상처 유발 모낭 성장을 향상시키는 반면, 상처 후 새로운 모낭의 발달은 DKK-1의 과발현에 의해 차단됩니다. β- 카테닌 (Ito et al., 2007). 흥미롭게도,이 연구에서 우리는 Col6a1-/- 마우스 의 향상된 상처 유발 모발 재성장이 상처 후 8 일에 더 높은 β- 카테닌 수치와 관련이있는 반면, 생리 학적 조건에서 β- 카테닌 수치는 약간 (상당하지는 않지만)이라는 것을 발견했습니다. 야생형 마우스에 비해 Col6a1-/- 마우스 의 피부가 더 낮습니다 . 이러한 발견은 콜라겐 VI가 암세포에서 β- 카테닌을 안정화하고 활성화 할 수 있다는 이전 연구와 일치합니다.Iyengar et al., 2005) 콜라겐 VI와 Wnt / β- 카테닌 신호 사이의 잠재적 인 양성 조절을 가리 킵니다. 이러한 맥락에서 Wnt / β-catenin 신호 전달이 동적으로 조절되고 별개의 미세 환경에 의존한다는 점을 강조해야합니다. 예를 들어, 모낭 발달이 시작되는 동안 Wnt / β-catenin 신호 전달은 먼저 상부 진피에서 균일하게 강화 된 다음 기본 진피 응축 물과 상피 모낭 기원 판 모두에서 집중적으로 강화됩니다 (Zhang et al., 2009; Chen 외, 2012; Myung et al., 2013). 이 개념과 일치하여 이전 연구에서는 콜라겐 VI의 부족이 β- 카테닌 신호를 불안정화하고 비활성화하여 종양 성장을 억제한다는 것을 보여주었습니다 (Iyengar et al., 2005), 여기서 우리는 콜라겐 VI의 절제가 Wnt / β-catenin 경로의 활성화에 의해 상처 유발 모발 재성장을 촉진한다는 것을 보여줍니다. Col6a1-/- 마우스 의 상처 유발 모발 재성장에서 Wnt / β- 카테닌 신호의 기여는 Wnt / β- 카테닌 억제제 ICG-001을 사용한 약리학 적 치료에 의해 뒷받침됩니다. 우리의 결과는 그 ICG-001 블록 증가 상처 유발 발모 향상된 K79 식 표시 - / - Col6a1 따라서 추가 증거를 제공하고, 해당 마우스의 증가 상처 유발 발모 Col6a1 - / -마우스는 Wnt / β-catenin 신호의 활성화에 의존합니다. 콜라겐 VI, 피부 상처 및 Wnt / β- 카테닌 신호 전달 사이의 연관성을 자세히 밝히기위한 추가 연구가 모낭 발달 및 상처 유발 모발 재성장을 제어하는 메커니즘에 대한 철저한 이해를 얻기 위해 필요하지만, 현재의 연구 결과는 상처 유발 모발 재성장에서 콜라겐 VI의 예상치 못한 역할.상처에 의해 모발 성장이 유발되는 이유는 아직 완전히 이해되지 않았습니다.Stenn과 Paus, 2001). 이 연구에서 우리는 콜라겐 VI가 주로 모낭에 침착되고 피부 상처에 의해 조절되며, 이는 차례로 Wnt / β- 카테닌 신호의 조절에 의해 모발 재성장을 조절 함을 보여줍니다. 흥미롭게도, 우리는 Col6a1-/- 마우스 에서 향상된 상처 유발 모발 재성장 이 정제 된 콜라겐 VI로 처리하면 폐지 된다는 것을 발견했습니다 . 전체적으로,이 연구는 상처 유발 모발 재성장에서 특정 ECM 분자의 역할에 대한 증거를 제공하고 콜라겐 VI를 표적화하여 손상된 모발 성장을 가속화하는 잠재적 인 치료 적 이점에 대해 밝힙니다.
재료 및 방법생체 실험은 쥐가 표시된 나이에 사용 된있는 모낭 개발 조사 연구를 제외하고 3 개월 된 쥐에 2에서 수행되었다. 네이티브 콜라겐 VI 단백질은 이전에 설명한대로 신생아 마우스에서 정제되었습니다 (Irwin et al., 2003). 동물 절차는 파도바 대학의 윤리위원회와 이탈리아 보건부의 승인을 받았습니다.생후 1, 4, 7, 14, 21 및 28 일에 생후 생리 학적 모발주기를 분석하기 위해 생쥐로부터 등쪽 피부를 얻었다. 성인 모발주기는 앞서 설명한대로 왁스 탈모에 의해 유도되었습니다상처 유발 모낭 성장 연구를 위해, 건강하고 상처 입은 야생형 및 Col6a1 -/- 마우스 의 등쪽 피부를 수확하고 액체 질소에서 냉동시켰다. 저온 유지 장치 (Leica, Wetzlar, Germany)를 사용하여 10μm에서 절단 한 후 샘플을 헤 마톡 실린과 에오신으로 염색하여 모낭의 형태를 분석했습니다.마우스를 자일 라진 (8 mg kg -1 체중) 및 케타민 (100 mg kg -1 체중) 으로 마취 시키고 등쪽 털을 면도 하였다. 피부 상처는 전체 두께의 등쪽 피부 1 cm 2 정사각형 (표시된대로 상처 치유 및 관련 모발 재성장을 조사하는 데 사용됨)을 절제하거나 3 개의 6 mm 상처 (중간 선 1 개 및 중앙선의 각면에 2 개)를 절단하여 만들어졌습니다. RNA 분리 및 실시간 역전사 -PCR제조업체의 지침에 따라 Trizol 시약 (Life Technologies, Gaithersburg, MD)을 사용하여 건강하고 상처 입은 야생형 마우스의 마우스 등쪽 피부로부터 총 RNA를 분리했습니다. 200ng의 총 RNA를 측정하여 Superscript III 키트 (Invitrogen, Carlsbad, CA)를 사용하여 보완 DNA를 만들었습니다. LightCycler 480 시스템 (Roche, Basel, Switzerland)을 사용하여 정량적 PCR을 수행했습니다. 각 유전자의 발현 수준은 Gapdh housekeeping 유전자 와 비교하여 계산되었습니다 . 이 연구에 사용 된 프라이머는 온라인 보충 표 S1에 나와 있습니다. 면역 형광면역 형광은 건강한 및 상처 입은 야생형 및 Col6a1 -/- 마우스의 동결 된 피부 절편에서 수행되었습니다 . 10 % 염소 혈청으로 1 시간 동안 차단 한 후 섹션을 4 ° C에서 밤새 1 차 항체 (1 : 200)와 함께 배양했습니다. 다음 단백질에 대한 1 차 항체가 사용되었습니다 : β-catenin, Notch1 (토끼 단일 클론; Abcam, Cambridge, MA); 콜라겐 VI (α1, α2 및 α3 (VI) 콜라겐에 대해 생성 된 토끼 폴리 클로 날 항체; (매사추세츠 주 액톤 소재의 피츠 제럴드); DKK-1, α1 (VI) 콜라겐 (토끼 폴리 클로 날; 산타 크루즈 바이오 테크놀로지, 캘리포니아 주 산타 크루즈 소재); Lhx2 (염소 폴리 클로 날; Santa Cruz Biotechnology); α3 (VI) 콜라겐 (독일 쾰른에있는 Raimund Wagener의 선물 인 기니피그 폴리 클로 날;Lettmann et al., 2014); 및 K15 (마우스 모노클로 날; Thermo Scientific, Rockford, IL). 그런 다음 샘플을 2 차 항체 (1 : 200) 및 Hoechst 33258 (Sigma, St. Louis, MO)으로 1 시간 동안 실온에서 옮겼습니다. 다음 2 차 항체가 사용되었습니다 : 항 염소 CY3, 항 토끼 CY2 및 CY3, 항 기니피그 CY2, 항 마우스 CY2 및 CY3 (Jackson Immunoresearch, West Grove, PA). 인산염 완충 식염수로 3 회 세척 한 후 80 % 글리세롤을 사용하여 슬라이드를 장착했습니다.마우스는 자궁 경부 탈구로 죽였고, 등쪽 피부가 건강하고 상처를 입었다 (상처 가장자리 및 주변 피부 5mm 포함) 야생형 및 Col6a1 -/-마우스를 제거하고 즉시 질소에서 냉동시켰다. 조직을 용해 완충액 (Millipore, Billerica, MA)에서 프로테아제 억제제 (Roche, Basel, Switzerland) 및 phosphatase 억제제 (Sigma)로 균질화했습니다. 핵 단백질 추출물의 제조는 제조업체의 지침에 따라 시판중인 핵 추출 키트 (Abcam)를 사용하여 수행되었습니다. 단백질 농도는 BCA 분석 (Thermo Scientific)을 사용하여 결정되었습니다. 20 μg의 단백질 샘플을 SDS-PAGE 겔 (Invitrogen)에 적용하고 폴리 비닐 리덴 플루오 라이드 막 (Millipore)에 블 롯팅했습니다. 막은 4 ° C에서 밤새 1 차 항체 (1 : 1,000)와 함께 배양되었습니다. 다음 단백질에 대한 1 차 항체가 웨스턴 블 롯팅에 사용되었습니다: α1 및 α3 (VI) 콜라겐; ERK2 (토끼 다 클론; Santa Cruz Biotechnology); K79 (염소 폴리 클로 날, Santa Cruz Biotechnology); β- 액틴 (마우스 단일 클론; Sigma); β- 카테닌; 및 Notch1. Tris-buffered saline과 Tween-20으로 세 번 세척 한 후, 멤브레인을 양 고추 냉이 퍼 옥시다아제 결합 2 차 항체 (1 : 1,000; Amersham Bioscience, 스위스 뒤벤 도르프 소재)와 함께 실온에서 1 시간 동안 배양했습니다. 화학 발광 (Pierce, Rockford, IL)을 사용하여 검출을 수행했습니다. 밀도 계 정량화는 Image-Pro Plus 6.0 소프트웨어 (Media Cybernetics, Rockville, MD)로 수행되었습니다. 각 분석은 3 회 이상 반복되었습니다. 스위스) 상온에서 1 시간 동안. 화학 발광 (Pierce, Rockford, IL)을 사용하여 검출을 수행했습니다. 밀도 계 정량화는 Image-Pro Plus 6.0 소프트웨어 (Media Cybernetics, Rockville, MD)로 수행되었습니다. 각 분석은 3 회 이상 반복되었습니다. 스위스) 상온에서 1 시간 동안. 화학 발광 (Pierce, Rockford, IL)을 사용하여 검출을 수행했습니다. 밀도 계 정량화는 Image-Pro Plus 6.0 소프트웨어 (Media Cybernetics, Rockville, MD)로 수행되었습니다. 각 분석은 3 회 이상 반복되었습니다. 유세포 분석마우스 등 피부로부터의 단일 세포 현탁액은 이전에 설명 된대로 제조되었습니다 (Bohr et al., 2013). 간단히 말해서, 해부 된 피부를 0.25 % 트립신 (Invitrogen)에 37 ° C에서 2 시간 동안 부유시킨 후 표피에서 진피를 분리했습니다. 분리 된 진피를 작은 조각으로 잘라내어 0.15 % IV 형 콜라게나 아제 (Sigma)로 37 ° C에서 40 분간 소화 한 다음 70μm 스트레이너 (BD Biosciences, San Jose, CA)를 통해 여과했습니다. 분리 된 세포를 인산염 완충 식염수로 세척 한 다음 CD49f에 대한 FITC 결합 항체 및 CD34에 대한 Alexa 647 결합 항체 (BD Biosciences)와 함께 4 ° C에서 30 분 동안 배양했습니다. 염색은 유세포 분석기 (BD Biosciences)로 분석되었습니다. 통계 분석데이터는 평균 ± SEM으로 표시됩니다. 데이터의 통계 분석은 Student 's t -test를 사용하여 수행되었습니다 . <0.05 의 P- 값은 유의 한 차이로 간주되었습니다.감사의 말α3 (VI) 콜라겐 항체를 제공 한 Raimund Wagener (독일 쾰른)와 유용한 힌트를 주신 Diana Corallo와 Rina Venerando에게 감사드립니다. 이 작업은 이탈리아 교육, 대학 및 연구부 (RBAP11Z3YA_003)와 파도바 대학 전략 프로젝트의 보조금으로 지원되었습니다. PC는 Cariparo Foundation의 펠로우쉽에 의해 지원됩니다.

|